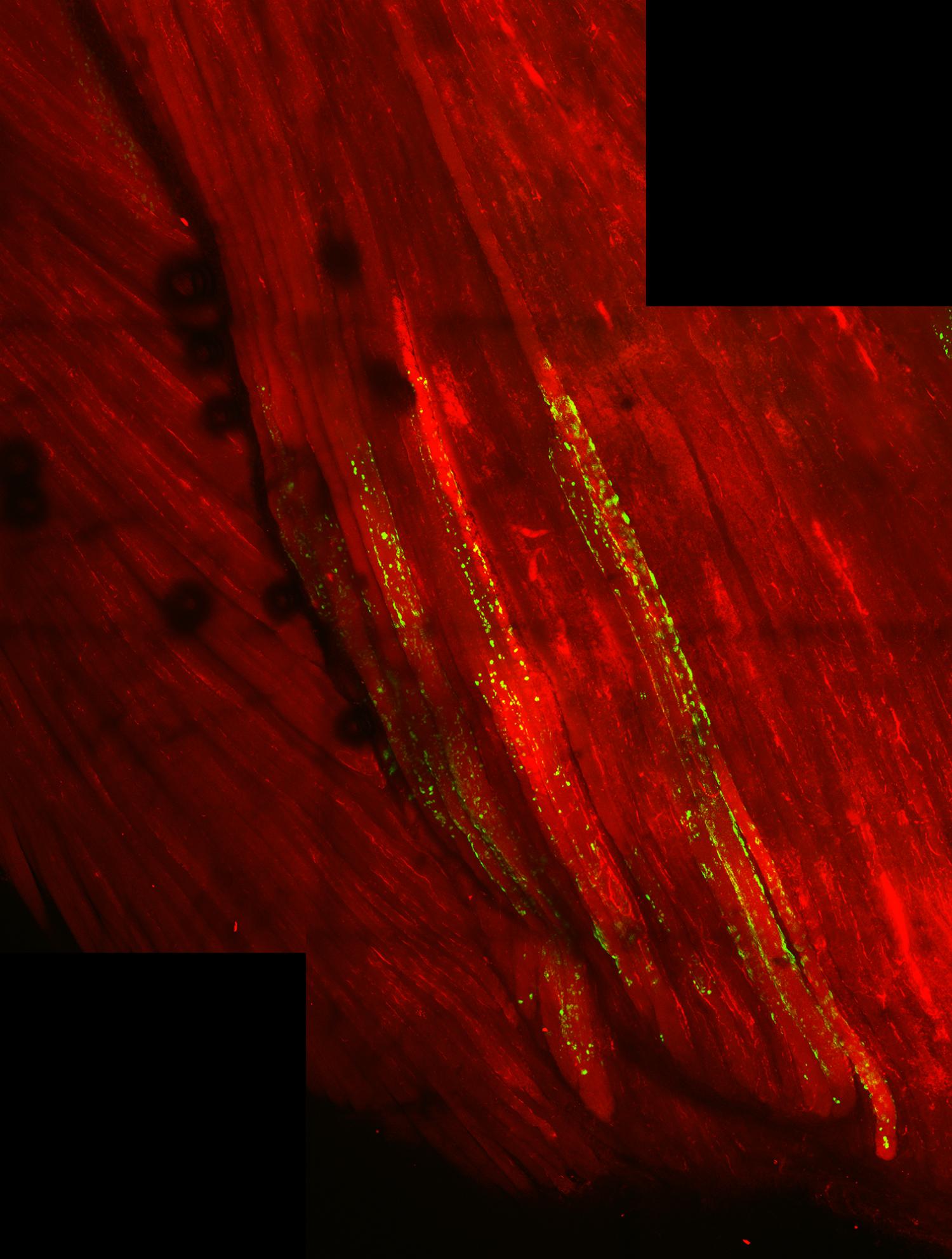
Immagine: le fibre muscolari (rosse) con TDP-43 si bloccano (verde). Credito: Cohen Lab.
Gli scienziati sanno da tempo che una proteina chiamata TDP-43 si aggrega nelle cellule cerebrali di persone con la SLA o sclerosi laterale amiotrofica ed è associata alla morte del moto neurone. Si pensa che questa stessa proteina sia la causa della degenerazione muscolare nei pazienti con Miosite sporadica da corpi di inclusione e questa convinzione ha portato molti ricercatori a pensare che TDP-43 è uno dei fattori causali sia della SLA che della sIBM.
( Vedi anche:Nuovo farmaco approvato per la SLA per la prima volta dopo 20 anni).
Ora, i ricercatori della scuola di medicina dell’ UNC e NC U(University of North Carolina) hanno rilevato che una specifica modifica chimica chiamata acetilazione promuove il blocco di TDP-43 negli animali. Utilizzando un metodo anti-aggregazione naturale nei modelli del topo, gli scienziati hanno invertito il blocco delle proteine nelle cellule muscolari e hanno impedito la debolezza muscolare correlata alle due condizioni.
Lo studio ha importanti implicazioni nella comprensione sia della SLA che della sIBM e nella creazione di potenziali nuovi trattamenti.
“Sospettiamo che sbarazzarsi di questo anormale cluster TDP-43 potrebbe essere una terapia potenziale per queste malattie”, ha dichiarato l’autore senior dello studio, Todd J. Cohen, docente di neurologia presso la UNC.
TDP-43 funziona normalmente nel nucleo delle cellule. Si lega al DNA e alle molecole di RNA trascritte dal DNA. La proteina sembra avere molte funzioni importanti nella regolazione del modo in cui i geni vengono espressi. In qualche modo – nelle persone con la sIBM, SLA e alcune altre malattie degenerative, TDP-43 si sposta dal nucleo.
La perdita di TDP-43 dal nucleo porta al fallimento della normale regolazione dell’espressione genica. Molti scienziati sospettano che questa sia la ragione principale per cui le cellule colpite muoiono. Nella SLA, la morte del moto neurone porta all’incapacità del cervello di controllare i muscoli volontari in tutto il corpo. Nella sIBM, la degenerazione muscolare porta alla debolezza muscolare e alla compromissione della forza.
Per molti anni, nessuno sapeva come TDP-43 si fosse spostato dal suo normale spazio di lavoro nel nucleo delle cellule . In uno studio del 2015, Cohen e colleghi hanno trovato un fattore possibile: una modifica chimica nota come acetilazione.
Le cellule usano comunemente l’acetilazione per attivare o disattivare l’attività delle proteine. Nel 2015, Cohen e colleghi hanno riferito che l’acetilazione in due punti su TDP-43 ha causato la separazione della proteina dall’ RNA. La proteina poi è scivolata nel citoplasma e ha cominciato ad aggregarsi. Questa ricerca è stata fatta in cellule cresciute in laboratorio. Ma per sottolineare la potenziale rilevanza per la malattia umana, gli scienziati hanno esaminato i neuroni motori spinali da pazienti SLA e identificato aggregati di TDP-43 che erano stati acetilati allo stesso modo.
“Potrebbe essere che l’acetilazione di TDP-43 funziona normalmente come un ‘interruttore’ che controlla la capacità di TDP-43 di legarsi ai suoi obiettivi – DNA e RNA”, ha dichiarato Cohen, membro del Centro di Neuroscienze della UNC.
Per il nuovo studio, i ricercatori hanno esaminato l’effetto di TDP-43 acetilato negli animali vivi. In questo caso, i ricercatori hanno cercato di simulare la sIBM nei topi, una condizione in cui TDP-43 si blocca nelle cellule muscolari.
Michael Bereman, uno degli autori dell’articolo e docente presso la NC State University, ha utilizzato la spettrometria di massa per studiare le modifiche alle proteine.
“È abbastanza sorprendente che una modifica che rappresenta lo 0,1 per cento della massa proteica può avere un effetto così dannoso e avviare essenzialmente i processi che culminano nella morte cellulare”, ha affermato Bereman, membro del Centro per la salute umana e l’ambiente dello stato NC. ” È altrettanto possibile che altre modifiche a questa proteina possano agire in modo analogo. Quindi è indispensabile studiarla con nuove tecnologie”.
“Ho la tendenza a vedere la sIBM e la SLA come risultanti sostanzialmente dello stesso processo patologico correlato a TDP-43 – l’effetto clumping – ma in diversi tipi di cellule”, ha spiegato Cohen. “Il vantaggio dello studio della sIBM è che le cellule muscolari sono molto più accessibili rispetto ai neuroni motori che sono colpiti nella SLA. Una volta compreso il ruolo di TDP-43 nella sIBM, possiamo anche studiare questo processo nei neuroni motori”.
Cohen ed il suo team hanno usato un metodo speciale per iniettare le proteine TDP-43 acetilizzate direttamente nelle cellule muscolari dei topi. In contrasto con le normali proteine TDP-43, queste proteine acetilizzate si aggregano rapidamente al di fuori del nucleo. Le cellule aggregate hanno mostrato molteplici caratteristiche che sono state osservate anche ella slBM umana.
I ricercatori hanno osservato marcatori cellulari che indicano che le cellule muscolari cercano attivamente di sbarazzarsi degli aggregati TDP-43. Cohen ed il suo team hanno scoperto che si potrebbero aumentare questi meccanismi di difesa cellulare e rimuovere rapidamente la maggior parte degli aggregati utilizzando il fattore di shock termico 1 (HSF1) , una proteina naturalmente nota che funziona come interruttore principale dei processi di aggregazione nelle cellule.
La squadra di Cohen ora spera di identificare composti con effetto anti-clumping per favorire la rimozione degli aggregati TDP-43 e l’eventuale recupero della funzione muscolare “.
Ha detto Cohen; “Speriamo e sospettiamo che un approccio simile potrebbe funzionare anche per la SLA”.
Fonte: Medicalxpress