Malattie cardiovascolari-Immagine Credit Public Domain-
I test per le varianti genetiche stanno guadagnando slancio nelle malattie cardiovascolari e stanno contribuendo a migliorare la diagnosi e il trattamento di precisione. Quali sono gli ultimi progressi della cardiogenomica e quali sono gli ostacoli all’adozione su larga scala?
“Molte malattie cardiovascolari causate da varianti di un singolo gene sono sottodiagnosticate perché il sequenziamento clinico è sottoutilizzato“, afferma Dan Rader, medico-scienziato a capo della Divisione di medicina traslazionale e genetica umana presso la Penn Medicine. Il suo team sta sequenziando grandi popolazioni eterogenee per capire in che modo le varianti genetiche rare contribuiscono alle malattie cardiovascolari. Stanno scoprendo che le cause curabili vengono perse perché i medici non stanno guardando i geni dei pazienti.
Dagli anni ’90, i test genetici nella pratica cardiologica sono stati raccomandati per i pazienti che presentano sintomi di una malattia cardiovascolare ereditaria o sono ad alto rischio perché esiste una variante patogena nota nella loro famiglia. La decisione di sottoporsi a test genetici viene condivisa tra il paziente e l’operatore sanitario dopo aver considerato i potenziali benefici, rischi e limiti del test.
Nel 2020, l’American Heart Association (AHA) ha rilasciato una dichiarazione che raccomanda test genetici per i pazienti con diagnosi di tutte le forme di cardiomiopatia, disturbi aritmici, disturbi vascolari e disturbi lipidici come l’ipercolesterolemia familiare. L’AHA ha anche evidenziato 30 geni utilizzabili dal punto di vista medico correlati a malattie cardiovascolari, da un elenco dell’American College of Medical Genetics and Genomics. Anche nei pazienti che hanno una diagnosi clinica di una malattia cardiovascolare ereditaria, i test genetici potrebbero identificare la mutazione responsabile e aiutare a personalizzare la loro cura“, afferma Kiran Musunuru, autore principale della dichiarazione e cardiologo e genetista presso il Penn Cardiovascular Institute.
I medici possono ordinare test genetici che vanno dal sequenziamento di un singolo gene o di un gruppo di geni che sono stati associati alla malattia, al sequenziamento imparziale dell’intero esoma o dell’intero genoma che interroga tutti i geni. Al momento, il sequenziamento dell’intero genoma è più comune negli ambienti di ricerca che in clinica perché serve ad approfondire la conoscenza delle relazioni gene-malattia. Tali studi stanno rivelando che ci sono spesso molteplici varianti geniche comuni a piccolo effetto (polimorfismi a singolo nucleotide) che aumentano cumulativamente il rischio di malattie cardiovascolari. I ricercatori possono utilizzare queste informazioni per generare punteggi di rischio poligenico che riflettono la suscettibilità di una persona alla malattia prima ancora che presentino sintomi.
È probabile che l’opportunità di adottare misure preventive acceleri l’uso del sequenziamento genetico ad alta copertura in ambito clinico. “Sebbene i medici diano ancora la priorità allo screening clinico, la genotipizzazione è una tendenza inevitabile perché, in definitiva, le malattie cardiovascolari hanno molte soluzioni cliniche“, afferma Wilson Tang, cardiologo esperto di insufficienza cardiaca e trapianti presso l’Heart, Vascular and Thoracic Institute della Cleveland Clinic. “Se la malattia cardiovascolare viene identificata precocemente, ci sono farmaci e procedure per migliorare il rischio e migliorare i risultati dei pazienti“.
La cardiogenomica può salvare vite umane
Man mano che i ricercatori imparano di più sui meccanismi attraverso i quali la variazione genetica contribuisce alla malattia, possono iniziare a esaminare gli effetti di farmaci noti su gruppi selezionati di pazienti o utilizzare questa conoscenza per svilupparne di nuovi.
Ad esempio, le mutazioni nei geni che codificano le subunità del canale ionico sono responsabili del 75% dei casi di sindrome del QT lungo (LQTS), un problema ereditario del ritmo cardiaco che può essere responsabile di circa 3.000 morti inaspettate in bambini e giovani adulti negli Stati Uniti ogni anno. I test per questi geni (KCNQ1, KCNH2, SCN5A) non solo confermano la diagnosi, ma possono anche guidare le decisioni terapeutiche poiché solo i pazienti con determinate mutazioni beneficeranno dei beta-bloccanti. Pertanto i test genetici non solo apportano benefici clinici, ma sono anche convenienti.
Ci vuole tempo perché le mutazioni recentemente scoperte associate alle malattie cardiache diventino parte del regime di test clinici. Molte varianti genetiche con comprovata influenza sul decorso o sul trattamento delle malattie cardiovascolari non sono ancora state testate.
Uno dei migliori esempi riguarda le mutazioni nel gene TTR che sono collegate all’amiloidosi cardiaca ereditaria, in cui la deposizione di amiloide nei muscoli cardiaci ostacola la capacità del cuore di pompare il sangue. “Esiste un trattamento efficace sul mercato per l’amiloidosi cardiaca ereditaria. Ma poiché è sottodiagnosticata e il test TTR non viene eseguito di routine, questi pazienti non sono idonei per il farmaco”, spiega Rader.
Allo stesso modo, i pazienti non vengono sequenziati per mutazioni nel gene LMNA, che è associato a cardiomiopatia dilatativa. “Nei dati estratti dalla Penn Medicine Biobank troviamo un bel po’ di persone che hanno mutazioni deleterie in LMNA e insufficienza cardiaca, ma una diagnosi genetica per questi pazienti non era stata presa in considerazione”, afferma Rader. Test per LMNA potrebbe accelerare la diagnosi, identificare i membri della famiglia a rischio e incoraggiare la sorveglianza di routine con test di screening cardiovascolare. E poi ci sono mutazioni in tre geni associati all’ipercolesterolemia familiare, che codificano per il recettore delle lipoproteine a bassa densità (LDLR), l’apolipoproteina B (APOB) e la proproteina convertasi subtilisina/kexina 9 (PCSK9). I test genetici per le versioni mutanti di questi geni vengono eseguiti raramente, anche se aumentano il rischio di questa condizione sempre più comune e potenzialmente fatale, ma curabile.
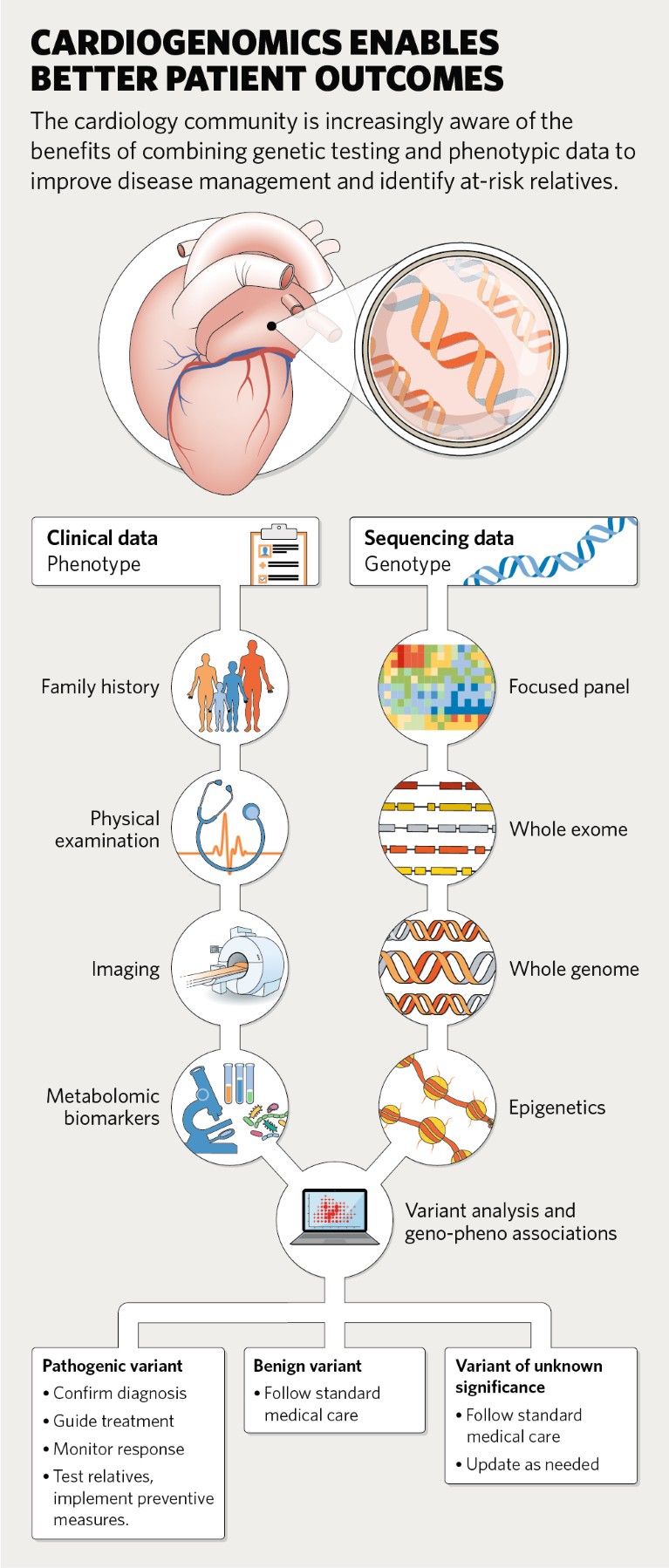
Ostacoli ai test genetici
Quando vengono rivelate le basi genetiche di molte malattie cardiovascolari, perché i test genetici non sono più ampiamente utilizzati? “L’ostacolo più grande è la mancanza di conoscenza dei test genetici da parte dei cardiologi e degli operatori sanitari in generale”, afferma Musunuru. “Se non è sul loro radar, non ordineranno i test”.
Inoltre, i medici possono non sospettare una condizione ereditaria data l’enfasi sulla storia familiare (o la sua mancanza) nella diagnosi clinica. “La storia familiare ha i suoi limiti in termini di decisione se una condizione è ereditata”, afferma Rader. “Se un paziente si presenta con cardiomiopatia dilatativa idiopatica e nessun altro nella sua famiglia ha la condizione, il cardiologo potrebbe non avere motivo di sospettare che abbia una causa genetica“.
Coinvolgere i cardiologi con i dati emergenti è fondamentale. “Quando abbiamo presentato i dati TTR ai cardiologi, hanno riconosciuto che probabilmente non stanno pensando o cercando l’amiloidosi cardiaca in modo aggressivo come dovrebbero”, afferma Rader.
Sebbene l’uso dei test genetici in cardiologia non sia così comune come nel cancro, Tang osserva che i cardiologi stanno diventando più sicuri e a loro agio nell’usarli. “Come in altre discipline, si riconosce che alcune varianti sono molto più maligne di altre”, spiega. “Identificarle ci consente di essere meglio preparati alla progressione in termini sia di manifestazione fenotipica che di risposta terapeutica“.
Affrontare le lacune
La cardiogenomica è ancora un campo giovane. Molte varianti genetiche associate a malattie cardiovascolari sono di significato sconosciuto e quindi di utilità clinica limitata. Un’ulteriore comprensione di come queste varianti interagiscono con altri geni e fattori ambientali aiuterà a determinarne la patogenicità.
C’è ancora molto da imparare sulle varianti genetiche ancestrali che causano malattie. La maggior parte dei dati genetici proviene da persone con origini europee, che hanno vulnerabilità genetiche diverse alle malattie rispetto alle persone di altre etnie. Le iniziative per sequenziare le popolazioni africane stanno iniziando ad affrontare questo problema. Ad esempio, una specifica variante TTR associata all’amiloidosi cardiaca si trova con una frequenza maggiore nelle persone di origine africana rispetto a quelle di origine europea, evidenziando l’utilità del test TTR in specifici gruppi etnici.
Un’altra considerazione importante è che alcune malattie cardiovascolari colpiscono in modo sproporzionato le donne, ma le linee guida per il trattamento si basano in gran parte su studi clinici sugli uomini. Man mano che più donne partecipano a studi di ricerca e vengono pubblicate più analisi specifiche per sesso, vi è un numero crescente di interventi specifici per genere per il trattamento e la gestione delle malattie cardiovascolari.
Diverse iniziative mirano a contribuire a far luce sui potenziali meccanismi genetici alla base delle differenze di sesso osservate. Il Women’s Genome Health Study (WGHS) ha esaminato i genomi di oltre 25.000 donne statunitensi inizialmente sane per identificare potenziali varianti genetiche associate a gravi incidenti sanitari, tra cui infarto del miocardio e ictus. Ma è un rapporto complicato. “Ci sono molte interazioni gene-ambiente in gioco“, dice Tang, “alcune legate a geni co-espressi o modificatori e altre probabilmente dovute a effetti dietetici, stile di vita o specifici del sesso (ormonali)”.
Vedi anche:Malattie cardiovascolari: nuovo approccio al trattamento
L’integrazione di altri dati “omici” aiuterà anche a chiarire il quadro delle malattie cardiovascolari. “Lo sviluppo di metodi per valutare i segni epigenetici nel tessuto cardiaco, per esaminare la proteomica su larga scala nel sangue e per la metabolomica, ci porterà a un altro livello di comprensione”, afferma Rader.
Cardiogenomica e prevenzione delle malattie
Decifrare come il codice genetico viene trascritto ed espresso è la chiave per la cura personalizzata. “Il sequenziamento di una singola cellula e la trascrittomica spaziale hanno rivoluzionato la nostra capacità di sottoclassificare le malattie in base ai loro meccanismi sottostanti a livello molecolare”, afferma Tang.
L’identificazione di mutazioni potenzialmente patogene avrà un impatto sostanziale sulla pratica della cardiologia. “Stiamo continuamente imparando a conoscere le basi genetiche, non solo delle classiche condizioni cardiovascolari ereditarie, ma anche di malattie comuni come l’infarto e la fibrillazione atriale“, afferma Musunuru.
Questa conoscenza sta aiutando nella prevenzione delle malattie attraverso un intervento precoce. “Nei prossimi anni, dovrebbe essere possibile utilizzare il sequenziamento dell’intero genoma molto presto nella vita per prevedere meglio la salute futura di una persona e incoraggiare le scelte per ridurre il rischio di malattia nel corso della vita“, aggiunge Musunuru, “che dovrebbe portare a tempi più lunghi e vite più sane”.
Fonte: Nature