Cardiogenomica-Immagine: diversi geni aiutano il cuore a mantenere un battito sano. Il sequenziamento di questi geni può aiutare a diagnosticare condizioni cardiache nascoste. Credito: TUMEGGY/SPL/Getty Images-
I test per le varianti genetiche stanno guadagnando slancio nelle malattie cardiovascolari e stanno contribuendo a migliorare la diagnosi e il trattamento di precisione. Quali sono gli ultimi progressi nel campo della cardiogenomica e quali sono gli ostacoli all’adozione su larga scala?
“Molte malattie cardiovascolari causate da varianti di un singolo gene sono sottodiagnosticate perché il sequenziamento clinico è sottoutilizzato”, afferma Dan Rader, medico-ricercatore a capo della Divisione di Medicina Traslazionale e Genetica Umana presso la Penn Medicine. Il suo team sta sequenziando grandi popolazioni eterogenee per capire come le varianti genetiche rare contribuiscono alle malattie cardiovascolari. I ricercatori tanno scoprendo che le cause curabili vengono perse perché i medici non esaminano i geni dei pazienti.
Dagli anni ’90, i test genetici nella pratica cardiologica sono stati raccomandati per i pazienti che presentano sintomi di una malattia cardiovascolare ereditaria o che sono ad alto rischio perché nella loro famiglia è presente una variante patogena nota. La decisione di sottoporsi al test genetico è condivisa tra il paziente e l’operatore sanitario dopo aver considerato i potenziali benefici, rischi e limiti del test.
Nel 2020, l’American Heart Association (AHA) ha rilasciato una dichiarazione in cui raccomanda test genetici per i pazienti con diagnosi di tutte le forme di cardiomiopatia, disturbi aritmici, disturbi vascolari e disturbi lipidici come l’ipercolesterolemia familiare. L’AHA ha inoltre evidenziato 30 geni utilizzabili dal punto di vista medico legati alle malattie cardiovascolari, da un elenco dell’American College of Medical Genetics and Genomics. “Anche nei pazienti che hanno una diagnosi clinica di una malattia cardiovascolare ereditaria, i test genetici potrebbero identificare la mutazione responsabile e aiutare a personalizzare la loro cura”, afferma Kiran Musunuru, autore principale della dichiarazione e cardiologo e genetista del Penn Cardiovascolare Institute.
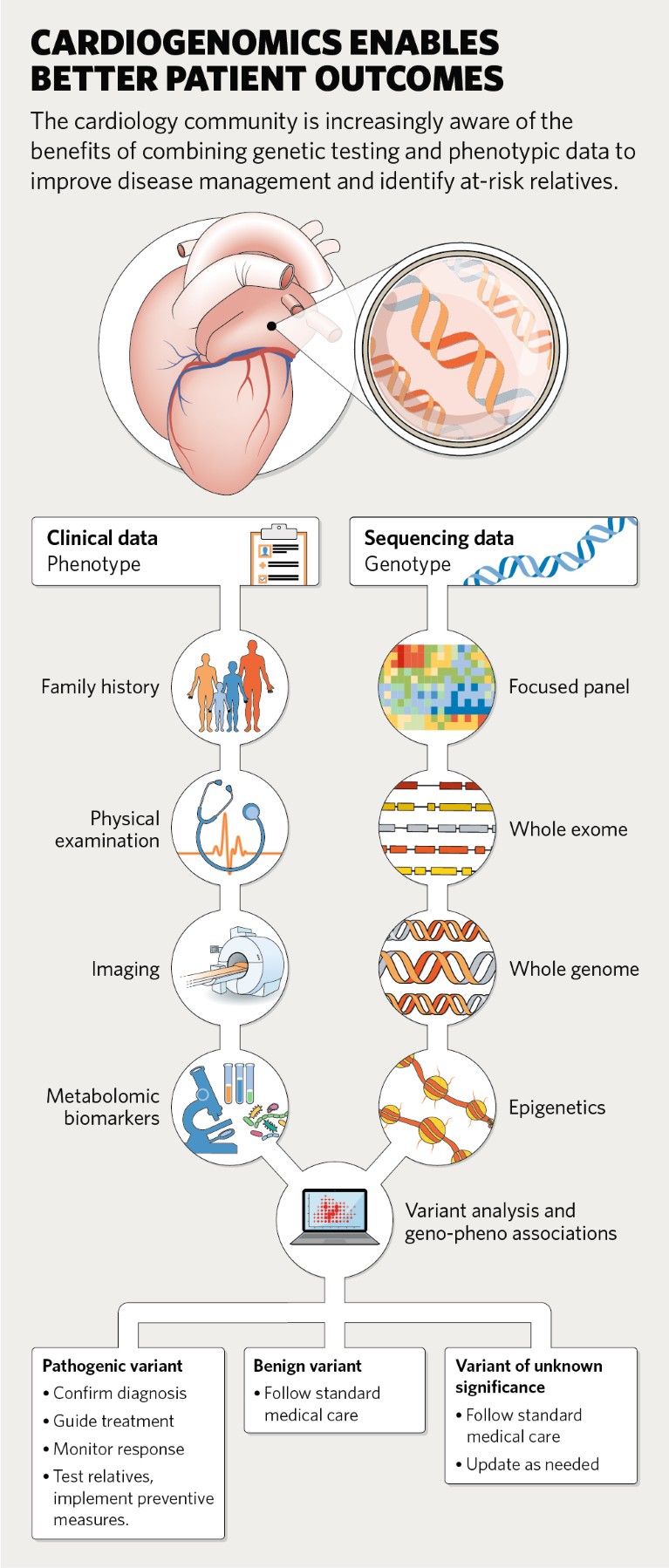
I medici possono ordinare test genetici che vanno dal sequenziamento di un singolo gene o di un gruppo di geni associati alla malattia, al sequenziamento imparziale dell’intero esoma o dell’intero genoma che interroga tutti i geni. Al momento, il sequenziamento dell’intero genoma è più comune negli ambienti di ricerca che in clinica perché serve ad approfondire la conoscenza delle relazioni gene-malattia. Tali studi stanno rivelando che spesso esistono più varianti genetiche comuni di piccolo effetto (polimorfismi a singolo nucleotide) che aumentano cumulativamente il rischio di malattie cardiovascolari. I ricercatori possono utilizzare queste informazioni per generare punteggi di rischio poligenico che riflettono la suscettibilità di una persona alla malattia prima ancora che presenti qualsiasi sintomo.
L’opportunità di adottare misure preventive probabilmente accelererà l’uso del sequenziamento genetico ad alta copertura in ambito clinico. “Sebbene i medici diano ancora priorità allo screening clinico, la genotipizzazione è una tendenza inevitabile perché, in definitiva, le malattie cardiovascolari hanno molte soluzioni cliniche“, afferma Wilson Tang, cardiologo per insufficienza cardiaca e trapianti presso l’Heart, Vascular and Thoracic Institute della Cleveland Clinic. “Se la malattia cardiovascolare viene identificata precocemente, esistono farmaci e procedure per ridurre il rischio e migliorare i risultati per i pazienti”.
La cardiogenomica può salvare vite umane
Man mano che i ricercatori apprendono di più sui meccanismi attraverso i quali la variazione genetica contribuisce alla malattia, possono iniziare a esaminare gli effetti di farmaci noti su gruppi selezionati di pazienti o utilizzare questa conoscenza per svilupparne di nuovi.
Ad esempio, le mutazioni nei geni che codificano per le subunità dei canali ionici sono responsabili del 75% dei casi di sindrome del QT lungo (LQTS), un problema ereditario del ritmo cardiaco che potrebbe essere responsabile di circa 3.000 morti inaspettate tra bambini e giovani adulti negli Stati Uniti ogni anno. Il test per questi geni (KCNQ1, KCNH2, SCN5A) non solo conferma la diagnosi, ma può anche guidare le decisioni terapeutiche poiché solo i pazienti con determinate mutazioni trarranno beneficio dai beta-bloccanti. Pertanto i test genetici non solo apportano benefici clinici, ma sono anche economicamente vantaggiosi.
Ci vuole tempo perché le mutazioni recentemente scoperte associate alle malattie cardiache diventino parte del regime di test clinici. Molte varianti genetiche con comprovata influenza sul decorso o sul trattamento delle malattie cardiovascolari non sono ancora state testate.
Uno dei migliori esempi riguarda le mutazioni nel gene TTR che sono collegate all’amiloidosi cardiaca ereditaria, dove la deposizione di amiloide nei muscoli cardiaci ostacola la capacità del cuore di pompare il sangue. “Esiste sul mercato un trattamento efficace per l’amiloidosi cardiaca ereditaria. Ma poiché è sottodiagnosticato e il test TTR non viene eseguito di routine, questi pazienti non sono idonei per il farmaco”, spiega Rader.
Allo stesso modo, i pazienti non vengono sequenziati per mutazioni nel gene LMNA che è associato alla cardiomiopatia dilatativa. “Estraendo dati dalla Penn Medicine Biobank troviamo molte persone che hanno mutazioni deleterie in LMNA e insufficienza cardiaca, ma queste mutazioni non erano stato preso in considerazione”, afferma Rader. Il test per l’LMNA potrebbe accelerare la diagnosi, identificare i membri della famiglia a rischio e incoraggiare la sorveglianza di routine con test di screening cardiovascolare. Inoltre ci sono mutazioni in tre geni associati all’ipercolesterolemia familiare, che codificano per il recettore delle lipoproteine a bassa densità (LDLR), l’apolipoproteina B (APOB) e proproteina convertasi subtilisina/kexina 9 (PCSK9). I test genetici per le versioni mutanti di questi geni vengono eseguiti raramente, anche se aumentano il rischio di questa condizione sempre più comune e potenzialmente fatale, ma curabile.
Ostacoli all’implementazione della cardiogenomica
Man mano che vengono rivelate le basi genetiche di molte malattie cardiovascolari, perché i test genetici non vengono più utilizzati? “L’ostacolo più grande è la mancanza di conoscenza sui test genetici da parte dei cardiologi e degli operatori sanitari in generale”, afferma Musunuru. “Se non sono sul loro radar, non ordineranno i test“.
Inoltre, i medici potrebbero non sospettare una condizione ereditaria data l’enfasi sulla storia familiare (o sulla sua assenza) nella diagnosi clinica. “La storia familiare ha i suoi limiti nel decidere se una condizione è ereditaria”, afferma Rader. “Se un paziente presenta una cardiomiopatia dilatativa idiopatica e nessun altro nella sua famiglia ha la condizione, il cardiologo potrebbe non avere motivo di sospettare che abbia una causa genetica“.
Coinvolgere i cardiologi con i dati emergenti è fondamentale. “Quando abbiamo presentato i dati TTR ai cardiologi, hanno riconosciuto che probabilmente non stanno pensando o cercando l’amiloidosi cardiaca in modo così aggressivo come dovrebbero“, afferma Rader.
Sebbene l’uso dei test genetici in cardiologia non sia così comune come nel cancro, Tang osserva che i cardiologi stanno diventando più sicuri e a proprio agio nell’utilizzarli. “Come in altre discipline, è riconosciuto che alcune varianti sono molto più maligne di altre“, spiega Rader. “Identificarli ci consente di essere meglio preparati alla progressione in termini sia di manifestazione fenotipica che di risposta terapeutica”.
Ma la consulenza non è sempre facile da mettere in atto. I pazienti devono essere consapevoli delle implicazioni dei test genetici, con sessioni prima e dopo la conoscenza dei risultati. “Questo dovrebbe essere fatto da consulenti genetici, che sono relativamente scarsi”, dice Musunuru.
Infine, ci sono preoccupazioni anche sul costo e sul rimborso dei test. Sebbene la maggior parte delle polizze assicurative riconoscano il beneficio dei test genetici per le malattie cardiovascolari, in particolare per identificare i parenti asintomatici a rischio, la copertura varia. “L’incertezza sul rimborso dei test può dissuadere i cardiologi dal richiederli”, afferma Rader. “Molti professionisti chiedono politiche di pagamento più coerenti”.
Affrontare le lacune
La cardiogenomica è ancora un campo giovane. Molte varianti genetiche associate alle malattie cardiovascolari sono di significato sconosciuto e quindi di utilità clinica limitata. Una migliore comprensione di come queste varianti interagiscono con altri geni e fattori ambientali aiuterà a determinarne la patogenicità.
C’è ancora molto da imparare sulle varianti genetiche ancestrali che causano malattie. La maggior parte dei dati genetici proviene da persone di origine europea, che presentano vulnerabilità genetiche alle malattie, diverse rispetto alle persone di altre etnie. Le iniziative per sequenziare le popolazioni africane stanno iniziando ad affrontare questo problema. Ad esempio, una variante TTR specifica associata all’amiloidosi cardiaca si riscontra con una frequenza più elevata nelle persone di origine africana rispetto a quelle di origine europea, evidenziando l’utilità del test TTR in specifici gruppi etnici.
Un’altra considerazione importante è che alcune malattie cardiovascolari colpiscono in modo sproporzionato le donne, tuttavia le linee guida per il trattamento si basano in gran parte su studi clinici condotti sugli uomini. Poiché sempre più donne partecipano a studi di ricerca e vengono pubblicate più analisi specifiche per sesso, vi è un numero crescente di interventi specifici per genere per il trattamento e la gestione delle malattie cardiovascolari.
Diverse iniziative mirano a contribuire a far luce sui potenziali meccanismi genetici alla base delle differenze sessuali osservate. Il Women’s Genome Health Study (WGHS) ha esaminato i genomi di oltre 25.000 donne statunitensi inizialmente sane per identificare potenziali varianti genetiche associate a gravi incidenti sanitari, tra cui infarto miocardico e ictus. Ma è un rapporto complicato. “Ci sono molte interazioni gene-ambiente in gioco”, afferma Tang, “alcune legate a geni co-espressi o modificatori e altre probabilmente dovute a dieta, stile di vita o effetti ormonali specifici del sesso”.
Anche l’integrazione di altri dati “omici” aiuterà a chiarire il quadro delle malattie cardiovascolari. “Lo sviluppo di metodi per valutare i segni epigenetici nel tessuto cardiaco, per esaminare la proteomica su larga scala nel sangue e per la metabolomica, ci porterà a un altro livello di comprensione”, afferma Rader.
Cardiogenomica e prevenzione delle malattie
Decifrare il modo in cui il codice genetico viene trascritto ed espresso è fondamentale per una cura personalizzata. “Il sequenziamento di singole cellule e la trascrittomica spaziale hanno rivoluzionato la nostra capacità di sottoclassificare le malattie in base ai loro meccanismi sottostanti a livello molecolare”, afferma Tang. È particolarmente interessato alla metabolomica e alla comprensione di come i fattori ambientali, come la dieta, influenzano l’espressione genetica. “Questa interazione dinamica è molto importante a livello clinico poiché può informare gli interventi che migliorano il rischio”, spiega il ricercatore.
L’identificazione di mutazioni potenzialmente patogene che hanno effetti attuabili avrà un impatto sostanziale sulla pratica della cardiologia . “Stiamo continuamente imparando a conoscere le basi genetiche non solo delle classiche condizioni cardiovascolari ereditarie, ma anche di malattie comuni come l’infarto e la fibrillazione atriale”, afferma Musunuru.
Leggi anche:La cardiogenomica può salvare vite umane
Questa conoscenza sta aiutando la prevenzione delle malattie attraverso un intervento precoce. “Nei prossimi anni, dovrebbe essere possibile utilizzare il sequenziamento dell’intero genoma molto presto nella vita per prevedere meglio la salute futura di una persona e incoraggiare scelte volte a ridurre il rischio di malattia nel corso della vita”, aggiunge Musunuru, “che si spera dovrebbe portare a tempi di vita più lunghi e vite più sane”.
Fonte: Nature