(Glioblastoma-Immagine Credit Wikipedia).
Ricercatori multi-istituzionali sono riusciti a fornire in modo efficiente un inibitore del checkpoint immunitario (ICI) nel cervello di topo, confermando la sua elevata efficacia e specificità nel trattamento di topi trapiantati ortotopicamente con glioblastoma (GBM).
La ricerca è stata pubblicata su Nature Biomedical Engineering.
I checkpoint immunitari sono una parte normale del sistema immunitario che impediscono a una risposta immunitaria di essere così forte da distruggere le cellule sane del corpo. I checkpoint immunitari si attivano quando le proteine sulla superficie delle cellule immunitarie chiamate cellule T riconoscono e si legano alle proteine partner su altre cellule, come alcune cellule tumorali. Per questa scoperta, il Professor Tasuku Honjo dell’Università di Kyoto è stato insignito del Premio Nobel per la Fisiologia o la Medicina nel 2018; sei tipi di ICI sono ora utilizzati nella pratica clinica per il trattamento del cancro. Tuttavia, mentre gli ICI hanno mostrato un’eccellente efficacia contro una varietà di tumori, non hanno mostrato un’efficacia soddisfacente negli studi clinici contro i tumori cerebrali maligni (comprese le metastasi cerebrali). Una delle ragioni di ciò è che la barriera emato- tumorale formata dalle pareti dei vasi sanguigni dei tumori cerebrali sopprime l’accumulo di inibitori del checkpoint immunitario nei tumori cerebrali. D’altra parte, le formulazioni di ICI possiedono una tossicità dose-limitante, che alla fine porta a eventi avversi correlati al sistema immunitario potenzialmente letali.
Quindi, l’obiettivo di questo studio era sviluppare una potente tecnologia per aumentare l’accumulo di ICI nei tumori cerebrali e per raggiungere sia l’efficacia terapeutica che la sicurezza. Avelumab, che ha dimostrato di essere immunologicamente attivo sia nell’uomo che negli animali, è stato utilizzato come ICI. Poiché il trasportatore del glucosio 1 (GLUT1) è sovraespresso sui capillari cerebrali e sul sistema vascolare GBM per supportare l’assorbimento di energia sufficiente, gli ICI con molecole di glucosio correttamente configurate hanno riconosciuto il GLUT1 nel sistema vascolare GBM per promuovere l’accesso al GBM con un accumulo di ~ 20 volte, rispetto agli anticorpi nativi.
Vedi anche:Glioblastoma multiforme:combinazione inibisce la crescita
Inoltre, la quantità di ICI accumulata nel sito del tumore cerebrale era 33 volte superiore a quella del tessuto cerebrale normale, indicando un’elevata selettività del tumore cerebrale.
La formulazione degli ICI ha recuperato la loro capacità di bloccare il PD-L1 nei tessuti tumorali tramite il distacco della catena PEG, mentre la loro attività è rimasta muta nei tessuti sani. Attraverso la consegna efficiente e la risposta immunitaria specifica, gli anticorpi modificati hanno raggiunto una potente efficacia antitumorale contro un modello GBM preclinico, che è una sfida per gli ICI in un contesto clinico (tasso di risposta completa del 60% in un modello GBM ortotopico di topo). Inoltre, il farmaco è stato somministrato una sola volta, con una dose bassa (1,5 mg/kg somministrato una volta in questo studio, rispetto alla dose standard del farmaco di 10 mg/kg somministrato più volte) ed è risultato essere sufficiente per ottenere l’effetto desiderato .
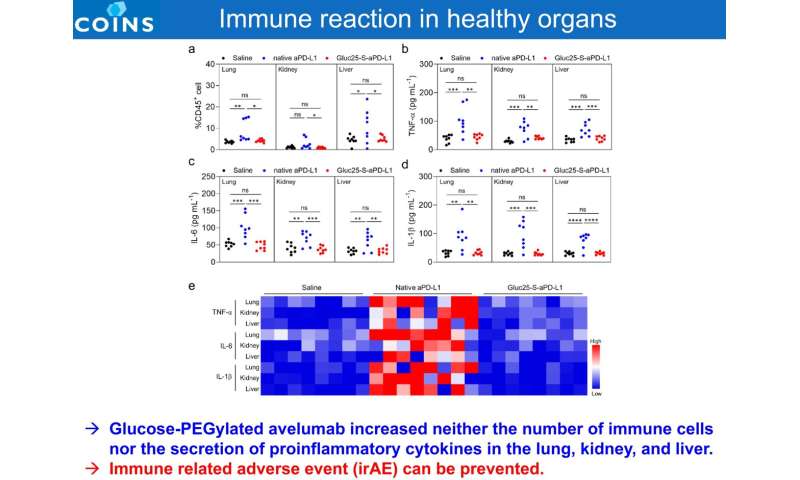
Avelumab glucosio-PEGilato non ha aumentato né il numero di cellule immunitarie né la secrezione di citochine proinfiammatorie nei polmoni, nei reni e nel fegato. L’evento avverso immuno-correlato (irAE) può essere prevenuto. Credito: 2021 Innovation Center di NanoMedicina
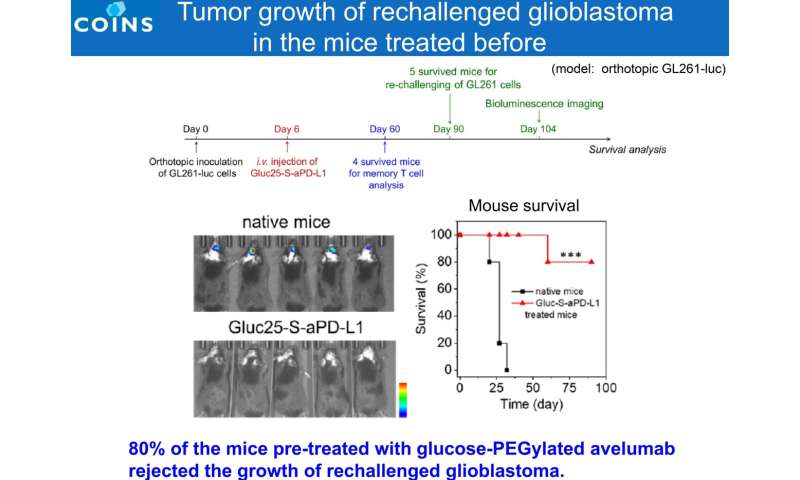
Dall’esame delle cellule immunitarie antitumorali nei tumori cerebrali di topi trattati con Glc-ICI, è stato dimostrato che il numero di cellule natural killer (NK) che attaccano il tumore e di cellule T CD8+ è aumentato, insieme all’efficace ripolarizzazione di M2-like macrofagi a macrofagi simili a M1 (uno stato antitumorale). Nel frattempo, anche il microambiente immunosoppressivo è stato rimodellato con una popolazione diminuita di cellule T regolatorie (Treg) e cellule immunosoppressive derivate dal midollo osseo (MDSC). Inoltre, cellule T di memoria effettrici sono state trovate nella milza di topi che hanno risposto a Glc-ICI e i cui tumori sono scomparsi entro 60 giorni (risposta completa), portando a un rigetto totale della recidiva tumorale. Sebbene GBM sia un tumore maligno che ricorre frequentemente, ci si aspetta che questi risultati siano applicabili alla prevenzione delle recidive di GBM.
Fonte:Medicalxpress