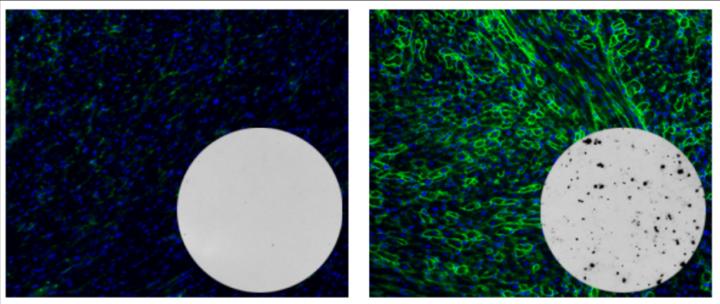
Immagine, queste immagini evidenziano il netto contrasto tra modelli murini di distrofia muscolare di Duchenne non trattata (a sinistra) e quelli trattati con una terapia genetica basata su CRISPR dopo un anno (a destra). A destra, il verde indica un livello più elevato di espressione genica di distrofina. Le macchie scure nell’inserto mostrano cellule T di questi topi che rispondono alla proteina batterica Cas9, indicando la presenza di una risposta immunitaria alla terapia. Credito Charles Gersbach, Duke University.
Le modifiche genetiche e il ripristino proteico nei modelli murini della distrofia muscolare di Duchenne rimangono vitali un anno dopo un singolo trattamento con CRISPR.
I ricercatori della Duke University hanno dimostrato che un singolo trattamento sistemico che utilizza la tecnologia di modifica del genoma CRISPR può correggere in modo sicuro e stabile una malattia genetica – la distrofia muscolare di Duchenne (DMD) – per più di un anno nei topi, nonostante le immunita osservate e risultati di editing genico alternativi.
Lo studio appare online il 18 febbraio sulla rivista Nature Medicine.
Nel 2016, Charles Gersbach, Rooney Family Associate Professor of Biomedical Engineering at Duke, ha pubblicato uno dei primi risultati del successo di CRISPR per trattare un modello animale di malattia genetica con una strategia che ha il potenziale per essere tradotta in terapia umana. Da allora sono stati pubblicati molti altri esempi e diverse terapie di modifica del genoma indirizzate a malattie umane sono attualmente in fase di sperimentazione clinica, con altre in arrivo.
L’ultima ricerca di Gersbach si concentra su un modello murino di DMD, causato dall’incapacità del corpo di produrre distrofina, una lunga catena proteica che lega l’interno di una fibra muscolare alla sua struttura di supporto circostante.
La distrofina è codificata da un gene contenente 79 regioni codificanti proteine, chiamate esoni. Se uno o più esoni vengono interrotti o eliminati da una mutazione ereditaria, la catena non si forma, causando il lento deterioramento dei muscoli.
Gersbach ha lavorato su potenziali trattamenti genetici per la Duchenne dal 2009. Il suo laboratorio è stato uno dei primi a concentrarsi su CRISPR / Cas9, una versione modificata di un sistema di difesa batterica che mira e divide il DNA dei virus invasori. Il suo approccio utilizza CRISPR / Cas9 per eliminare gli esoni della distrofina attorno alla mutazione genetica, lasciando il naturale sistema di riparazione del DNA del corpo per ricucire il restante gene insieme e creare una versione abbreviata – ma funzionale – del gene della distrofina.
“Mentre continuiamo a lavorare per sviluppare terapie genetiche basate su CRISPR, è fondamentale testare le nostre ipotesi e valutare rigorosamente tutti gli aspetti di questo approccio”, ha detto Gersbach. “Un obiettivo dei nostri esperimenti era di testare alcune idee in discussione sul campo, che ci aiuteranno a capire il potenziale di CRISPR nel trattamento delle malattie genetiche in generale e della distrofia muscolare di Duchenne in particolare, tra cui il monitoraggio della durata a lungo termine della risposta di fronte alle potenziali risposte immunitarie contro la proteina batterica Cas9″.
Il primo studio di otto settimane ha dimostrato che la distrofina funzionale è stata ripristinata e la forza muscolare aumentata. Tuttavia, non ha esplorato la durata a lungo termine del trattamento.
“È opinione diffusa che l’editing genico porti a una correzione genetica permanente“, ha affermato Gersbach. “Tuttavia, è importante esplorare le possibilità teoriche che potrebbero minare gli effetti dell’editing genetico, come perdere le cellule trattate o una risposta immunitaria”.
L’obiettivo del nuovo studio era di esplorare i fattori che potrebbero alterare gli effetti a lungo termine dell’editing genico basato su CRISPR / Cas9.
Christopher Nelson, post-dottorando nel laboratorio di Gersbach che ha diretto il lavoro, ha somministrato una singola dose della terapia CRISPR per via endovenosa a topi adulti e neonati portatori di un gene distrofina difettoso. Nel corso dell’anno successivo, i ricercatori hanno misurato il numero di cellule muscolari modificate con successo e quali tipi di alterazioni genetiche sono state apportate, oltre alla generazione di qualsiasi risposta immunitaria contro la proteina batterica CRISPR, Cas9, che funge da “forbice” che fa tagli al genoma.
Altri studi hanno riportato che il sistema immunitario del topo può generare una risposta a Cas9, che potrebbe potenzialmente interferire con il beneficio delle terapie CRISPR. Diversi gruppi hanno anche riferito che alcune persone hanno un’immunità preesistente alle proteine Cas9, probabilmente a causa dell’esposizione precedente all’ospite batterico.
“La buona notizia è che anche se abbiamo osservato sia le risposte anticorpalia Cas9 che le cellule T, nessuna delle due sembra aver causato tossicità in questi topi“, ha detto Nelson. “La risposta inoltre non ha impedito la capacità della terapia di modificare con successo il gene della distrofina e di produrre un’espressione proteica a lungo termine”.
I risultati hanno anche suggerito approcci per affrontare potenziali sfide, qualora dovessero insorgere in futuro. Ad esempio, i ricercatori hanno osservato che quando topi di due giorni senza sistemi immunitari completamente sviluppati sono stati trattati per via endovenosa, non è stata rilevata alcuna risposta immunitaria. L’editing del genoma CRISPR è rimasto stabile e, in alcuni casi, addirittura rafforzato nel corso di un anno. Si potrebbe immaginare di somministrare la terapia ai bambini come metodo per aggirare o modulare una risposta immunitaria indesiderata.
Vedi anche, CRISPR blocca la progressione della distrofia muscolare di Duchenne nei cani.
Gersbach e Nelson riconoscono, tuttavia, che il sistema immunitario del topo spesso funziona in modo molto diverso dal sistema immunitario umano. E lo screening neonatale per DMD non è attualmente ampiamente eseguito; la maggior parte delle diagnosi di Duchenne si verificano quando i bambini hanno dai tre ai cinque anni. Per affrontare questa sfida, Gersbach ha affermato che sopprimere il sistema immunitario durante il trattamento può essere un approccio praticabile.
I ricercatori stanno anche studiando potenziali strategie per limitare l’espressione o il rilascio di Cas9 alle sole cellule muscolari per brevi periodi per ridurre la rilevazione immunitaria.
“Siamo stati lieti di osservare che tutti i topi stavano bene un anno dopo il trattamento, ma i nostri risultati mostrano che ci deve essere maggiore attenzione alla risposta immunitaria mentre ci spostiamo verso modelli animali più grandi”, ha detto Nelson.
Nelson e Gersbach hanno precedentemente studiato il potenziale di editing fuori target da parte di CRISPR / Cas9 per modificare involontariamente altri siti nel genoma e hanno segnalato un’attività minima nei probabili siti fuori bersaglio. Altri studi recenti, tuttavia, hanno riportato che CRISPR può talvolta apportare modifiche genetiche nel sito corretto, ma non nel modo voluto. Ad esempio, alcuni studi hanno dimostrato che CRISPR può tagliare sezioni genetiche molto più grandi del previsto o che pezzi di DNA possono essere incorporati nel sito del taglio. Questi tipi di modifiche non erano stati precedentemente segnalati negli studi di modifica del genoma poiché i metodi utilizzati hanno rilevato solo la modifica desiderata.
Per mappare in modo completo tutte le modifiche che si verificano nel gene della distrofina, Nelson ha usato un approccio di sequenziamento del DNA che riporta in modo agnostico qualsiasi tipo di modifica. Sorprendentemente, sono stati fatti molti tipi di modifiche oltre alla rimozione prevista dell’esone bersaglio, incluso un alto livello di inserimento di sequenze di DNA dal vettore virale che codifica il sistema CRISPR / Cas9.
A seconda del tipo di tessuto e del dosaggio di CRISPR erogato, circa la metà delle modifiche sul target hanno portato a questi cambiamenti di sequenza alternativi. Sebbene questo risultato sia stato sorprendente, le modifiche involontarie alla sequenza non sembrano avere un impatto sulla sicurezza o l’efficacia di questo approccio di modifica del gene CRISPR / Cas9 per la DMD.
“Nessuno di questi cambiamenti sarebbe necessariamente un motivo di preoccupazione in questo caso perché il gene della distrofina è già difettoso“, ha detto Nelson. “Detto questo, qualsiasi risultato non intenzionale potrebbe potenzialmente rridurre l’efficienza dell’editing genico che stai cercando di raggiungere, il che supporta l’importanza di progettare modi per identificare obiettivamente e mitigare modifiche alternative negli studi futuri”.
“Studi precedenti hanno suggerito che alcuni di questi altri tipi di modifiche potrebbero verificarsi”, ha detto Gersbach. “Ma questa è una delle prime misurazioni complete di questi eventi in un modello animale che utilizza un approccio terapeuticamente rilevante. Andando avanti, questo fenomeno deve essere monitorato attentamente e meglio compreso.
Fonte, Nature