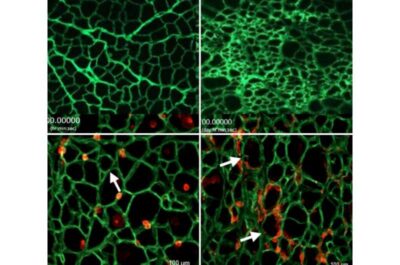
Distrofia muscolare di Duchenne-Immagine: in alto, a sinistra: un mioponteggio sano. In alto a destra: un’impalcatura per la distrofia muscolare di Duchenne. In basso a sinistra: cellule staminali (rosse) che crescono in un’impalcatura mioscopica sana (verde). In basso a destra: Cellule staminali che crescono in un myoscaffold di Duchenne (verde). Credito: Rachelle Crosbie-
I muscoli che fanno male dopo un duro allenamento di solito non fanno male a lungo, grazie alle cellule staminali che si precipitano nel sito danneggiato lungo le “autostrade del collagene” all’interno del muscolo e riparano il tessuto danneggiato. Ma se le cellule non possono raggiungere la loro destinazione, il tessuto danneggiato non può rigenerarsi. Nel tempo, si rompe completamente e cessa di funzionare.
In uno studio recentemente pubblicato su npj Regenerative Medicine , un gruppo di ricercatori guidati da biochimici dell’UCLA mostra per la prima volta che la cicatrizzazione della struttura del collagene che trasporta queste cellule curative fa sì che i muscoli smettano gradualmente di funzionare nella distrofia muscolare di Duchenne. La scoperta nei topi illumina una ragione per cui la terapia con cellule staminali non è stata efficace per il disturbo: le cellule semplicemente non possono arrivare dove sono più necessarie.
La distrofia muscolare di Duchenne è la più comune e una delle più gravi distrofie muscolari ereditarie. La malattia del deperimento muscolare, che di solito colpisce i ragazzi, inizia nell’infanzia e finisce inevitabilmente con la morte quando i muscoli che alimentano il cuore, i polmoni e altri organi vitali cedono. È causata da una mutazione nel gene della proteina distrofina, che regola l’organizzazione delle cellule muscolari. Nelle persone sane, la distrofina aiuta i fasci di cellule muscolari chiamate miofibre ad attaccarsi alla struttura del collagene, la matrice extracellulare che dà ai muscoli la loro forma, li tiene insieme e fornisce “la strada” alle cellule staminali per riparare e rigenerare il tessuto danneggiato.
Rachelle Crosbie, una Prof.ssa di biologia e fisiologia integrativa dell’UCLA che sta cercando modi per trattare la distrofia muscolare di Duchenne, sospettava che la disfunzione causata da questa mutazione portasse alla cicatrizzazione e all’irrigidimento della matrice extracellulare, un processo noto come fibrosi.
Crosbie e Kristen Stearns-Reider, una borsista postdottorato nel laboratorio di Crosbie, hanno progettato un esperimento unico per scoprirlo. Utilizzando le strutture del California NanoSystems Institute dell’UCLA, hanno ideato un processo per “lavare via” tutte le cellule dalla matrice extracellulare di collagene nei topi sani e in quelli con distrofia muscolare di Duchenne.
Al microscopio, le due matrici prive di cellule, che Crosbie chiama “myoscaffolds”, apparivano molto diverse: quella sana sembrava un pizzo delicato, mentre quella di Duchenne sembrava più una spugna densa.
Successivamente, i ricercatori hanno seminato ogni mioponteggio con cellule staminali e hanno osservato mentre le cellule cercavano di far crescere il tessuto muscolare. Le cellule staminali muscolari sono cresciute sui mioponteggi esattamente come farebbero nei muscoli sani e malati: nel mioponteggio sano e di pizzo, le cellule sono migrate lungo i fili lisci e si sono depositate in fori equidistanti. Tuttavia, le superfici irregolari e ispessite del mioponteggio di Duchenne hanno reso difficile il viaggio e hanno sollevato blocchi che hanno causato l’accumulo di cellule in gruppi; le cellule erano stressate e incapaci di progredire in modo efficiente.
“Come i pendolari suburbani, le cellule staminali residenti vivono alla periferia della fibra muscolare e viaggiano lungo la fibra muscolare verso le aree danneggiate e rigenerano il muscolo. La matrice extracellulare è l’autostrada che usano“. disse Crosby. “È come la differenza tra andare al lavoro in macchina in un giorno normale rispetto al giorno in cui una frana è caduta in autostrada”.
“Questa è la prima volta che gli scienziati hanno ripreso le cellule viventi in un’impalcatura fibrotica, rivelando specificamente come la fibrosi interrompe il comportamento cellulare”, ha detto Crosbie.
Anche i fili sottili ed elastici dell’impalcatura sana hanno ceduto leggermente quando le cellule staminali vi si sono attaccate, una deformazione fondamentale per il successo dello sviluppo del tessuto muscolare. Le cellule staminali non sono state in grado di deformare le fibre spesse e rigide dell’impalcatura di Duchenne. Il tessuto cresciuto sull’impalcatura di Duchenne ha mostrato grandi ciuffi di miofibre intervallati da ciuffi ancora più grandi di collagene invece delle miofibre uniformemente distribuite osservate nel campione sano.
Vedi anche:Distrofia muscolare di Duchenne: una proteina la chiave per la rigenerazione muscolare
Il sarcospan proteico offre una potenziale via da seguire
Il team di ricerca ha quindi testato il comportamento cellulare su un’impalcatura di miopodi Duchenne creata utilizzando una proteina terapeutica chiamata Sarcospan, che è nota per stabilizzare la matrice extracellulare. La funzione delle cellule staminali è migliorata una volta che il sarcospan ha ridotto al minimo la formazione di cicatrici fibrotiche.
“I risultati hanno chiarito perché le terapie con cellule staminali si sono dimostrate impegnative per la distrofia muscolare di Duchenne“, ha affermato Crosbie. “Trovare modi per prevenire o ridurre le cicatrici sulla matrice extracellulare potrebbe renderle più efficaci”.
“Questi mioscaffold offrono diverse ampie possibilità per lo studio delle interazioni tra cellule staminali e matrice extracellulare , la formazione di nicchie di cellule staminali, i microambienti che influenzano il comportamento delle cellule staminali, la maturazione muscolare e la modellazione della malattia”, hanno detto i coautori dello studio Michael Hicks, borsista postdottorato dell’UCLA, e April Pyle., Professore di microbiologia, immunologia e genetica molecolare all’UCLA.
Crosbie ha anche osservato che, poiché il nuovo metodo richiede solo campioni molto piccoli, questi studi potrebbero potenzialmente essere estesi per includere singoli pazienti, utilizzando il tessuto di una biopsia muscolare per studiare i trattamenti prima che vengano somministrati e identificare quelli che hanno maggiori probabilità di essere efficaci.