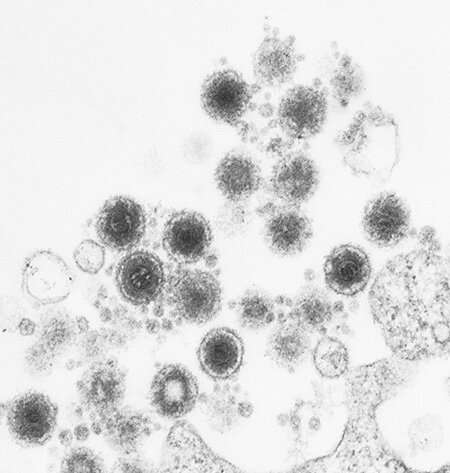
Immagine: cellule coltivate con copia latente del DNA HHV-6 prima e dopo il trattamento con siero. A e B: le reti mitocondriali verdi sono normalmente filamentose. C: Dopo il trattamento con siero di controllo sano, i mitocondri rimangono allungati. D: Dopo il trattamento con siero di pazienti MD / CFS, i mitocondri sono frammentati e la produzione di ATP è stata ridotta. Credito: UC San Diego Health Sciences.
L’encefalomielite mialgica o Sindrome da stanchezza cronica (ME / CFS) è una malattia invalidante e complessa. Le persone affette spesso non possono svolgere attività ordinarie – fisiche o mentali – a causa di una perdita invalidante di energia e di altri sintomi e possono rimanere confinate a letto o relegate per anni in casa.
Chiunque può sviluppare la Sindrome da stanchezza cronica, sebbene colpisca più comunemente le persone di età compresa tra 40 e 60 anni e le donne più spesso degli uomini. In quasi tutti i casi, la ME / CFS inizia dopo una sequenza di gravi esposizioni ambientali, lesioni o infezioni. Fino a tempi relativamente recenti, il mistero e la complessità di questa Sindrome hanno convinto in parte che non si trattava di una condizione “reale“. Nel 2015, la National Academy of Medicine ha dichiarato che la ME / CFS è una malattia grave, cronica, complessa e sistemica.
In un nuovo studio, che sarà pubblicato nell’edizione del 1 ° maggio 2020 di ImmunoHorizons, un team di ricercatori della University of California San Diego School of Medicine e tre Università tedesche descrivono una base biologica fondamentale per la Sindrome da stanchezza cronica che illustra come gli sforzi del corpo per rafforzare le protezioni del sistema immunitario possono avere un costo fisiologico altrove nel corpo.
L’encefalomielite mialgica / sindrome da affaticamento cronico (ME / CFS) è un disturbo multifattoriale con molti possibili fattori scatenanti. L’herpesvirus umano (HHV) –6 e l’HHV-7 sono due fattori scatenanti infettivi per i quali è l’evidenza dell’implicazione nella condizione. Per comprendere il possibile ruolo causale di HHV-6 in ME / CFS, sono stati studiati fenotipi metabolici e antivirali di cellule U2-OS con e senza HHV-6 cromosomicamente integrato e con o senza riattivazione del virus utilizzando l’inibitore dell’istone deacetilasi trichostatin-A. In conclusione, la riattivazione dell’HHV-6 nei pazienti con ME / CFS attiva una risposta multisistemica, proinfiammatoria, di pericolo cellulare che protegge da alcune infezioni da virus RNA e DNA, ma a scapito della frammentazione mitocondriale e del metabolismo energetico gravemente compromesso.
“Questi risultati sono importanti perché mostrano per la prima volta che esiste un’attività antivirale nel siero di pazienti con ME / CFS strettamente associata a un’attività che frammenta la rete mitocondriale e riduce la produzione di energia cellulare (ATP)”, ha detto Robert Naviaux, MD, Ph.D., Professore di medicina, pediatria e patologia presso la UC San Diego School of Medicine.
Naviaux è co-senior autore dello studio con Bhupesh K. Prusty, Ph.D., scienziato presso il Dipartimento di Microbiologia e Istituto di Virologia e Immunobiologia dell’Università Julius Maximilians di Würzburg, in Germania.
“Ciò fornisce una spiegazione per l’osservazione comune che i pazienti con ME / CFS spesso segnalano una forte riduzione del numero di raffreddori e altre infezioni virali che sperimentano dopo aver sviluppato la malattia. Il nostro lavoro ci aiuta anche a capire il noto, ma poco compreso legame di ME / CFS con le infezioni con Human Herpes Virus-6 (HHV-6) o HHV-7 “, ha detto Naviaux.
Immagine: microfotografia elettronica di particelle di herpes virus-6 umano che germogliano da una cellula. Credito: UC San Diego Health Sciences.
Oltre il 90% delle persone è esposto all’HHV-6 entro i tre anni. Il DNA del virus può inserirsi in un cromosoma e rimanere latente in poche cellule per anni, copiandolo silenziosamente ogni volta che la cellula si divide. Per la maggior parte delle persone, questo non causa problemi. “Tuttavia, abbiamo scoperto che l’esposizione a nuovi stress metabolici o ambientali ha causato alle cellule con una copia integrata di HHV-6 di secernere un’attività che ha avvertito le cellule della minaccia“, ha detto Naviaux. “L’attività secreta non solo ha protetto le cellule vicine e lontane dalle nuove infezioni da virus RNA e DNA, ma ha anche frammentato la rete mitocondriale e ridotto la loro capacità di riserva intracellulare ATP. Le cellule senza una copia integrata di HHV-6 non secernono l’attività antivirale. I nostri risultati mostrano che la fatica bioenergetica cellulare e la difesa cellulare sono due facce della stessa medaglia nella Sindrome da stanchezza cronica. Quando l’energia viene utilizzata per la difesa cellulare, non è disponibile per le normali funzioni cellulari come la crescita, la riparazione, le funzioni neuroendocrine e del sistema nervoso autonomo “.
I risultati illuminano ulteriormente un concetto chiamato teoria della risposta al pericolo cellulare, che Naviaux e colleghi stanno studiando da anni. La teoria della CDR ipotizza che la malattia cronica sia la conseguenza del naturale ciclo di guarigione che viene bloccato da interruzioni a livello metabolico e cellulare. In questo caso, le persone con ME / CFS hanno ottenuto protezioni contro alcuni tipi di infezioni, ma a costo di frammentare la funzione mitocondriale. La persistenza di mitocondri frammentati e le anomalie associate nella segnalazione cellulare bloccano la normale guarigione e recupero e possono portare a una vita di malattia.
I mitocondri sono organelli nelle cellule che scindono i nutrienti per creare un combustibile chiamato adenosina trifosfato (ATP), il vettore energetico primario in tutti gli organismi viventi. L’ATP fornisce l’energia utilizzata per guidare molti processi cellulari, tra cui contrazioni muscolari, impulsi nervosi e sintesi chimica.
“Questo documento rappresenterà un cambiamento di paradigma nella nostra comprensione delle potenziali cause infettive alla base della Sindrome da stanchezza cronica. L’herpesvirus umano 6 e l’HHV-7 sono stati a lungo pensati per svolgere un ruolo in questa malattia, ma non si conosceva quasi alcun meccanismo causale prima”, ha detto il coautore senior Prusty. “Per la prima volta, mostriamo che anche poche cellule infette o riattivate HHV-6 possono guidare una potente risposta di rimodellamento metabolico e mitocondriale che può spingere anche le cellule non contenenti virus verso uno stato ipometabolico (anormalmente basso metabolico). Cellule ipometaboliche sono resistenti ad altre infezioni virali e a molti stress ambientali, ma ciò comporta costi e sintomi gravi per i pazienti con ME / CFS”.