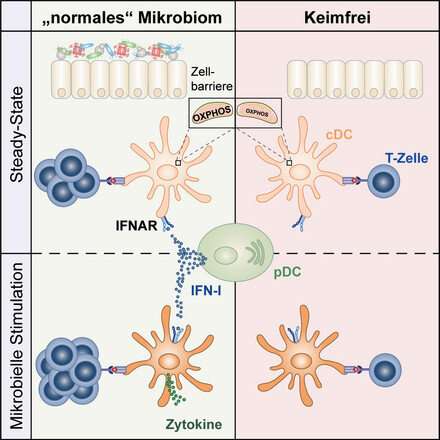
Immagine: gli interferoni di tipo I indotti dal microbiota controllano la funzionalità delle cellule dendritiche. Credito: Schaupp / Charité.
Lavorando a fianco dei colleghi di Magonza, Berna, Hannover e Bonn, i ricercatori di Charité – Universitätsmedizin Berlin, il Berlin Institute of Health (BIH) e il German Rheumatism Research Center Berlin (DRFZ) sono stati in grado di dimostrare come il microbioma aiuta a rendere il sistema immunitario in grado di rispondere ai patogeni.
Se i segnali derivati dal microbioma sono assenti, i mediatori pertinenti non vengono rilasciati, con conseguente incapacità di attivare i processi metabolici in alcune cellule immunitarie. Secondo il rapporto dei ricercatori, che è stato pubblicato su Cell, questo lascia le cellule pertinenti senza il carburante necessario per innescare una risposta immunitaria.
Risiedendo nelle interfacce ambientali, i tessuti epiteliali del corpo rappresentano potenziali gateway per agenti patogeni. Questi tessuti sono anche naturalmente colonizzati da una complessa comunità di batteri, virus, funghi e parassiti noti come il microbioma. È probabile che, nel corso dell’evoluzione, interazioni permanenti con questi microrganismi abbiano portato allo sviluppo di solidi percorsi di segnalazione che proteggono il corpo.
Un team di ricercatori guidato dal Prof. Dr. Andreas Diefenbach, Direttore dell’Istituto di microbiologia, malattie infettive e immunologia del Charité, ha studiato il ruolo del microbioma nella risposta immunitaria dell’organismo contro i patogeni nocivi e gli effetti che ne derivano sui percorsi di segnalazione.
La presenza di un’infezione innesca la risposta immunitaria del corpo. Un ruolo chiave in questo processo è svolto dalle cellule dendritiche convenzionali (CDC). Queste cellule fanno parte del sistema immunitario innato del corpo e trasportano una serie di recettori di riconoscimento dei modelli che consentono loro di rilevare rapidamente agenti patogeni invasori. La risposta iniziale delle cellule comporta il rilascio di citochine, che segnalano proteine che attraggono le cellule immunitarie nel sito di infezione. Allo stesso tempo, queste cellule usano anche la fagocitosi per inghiottire e digerire i patogeni invasivi, dopo di che presentano singole particelle come antigeni sulla loro superficie cellulare. Questo, a sua volta, porta all’attivazione delle cellule T, che fanno parte del sistema immunitario adattivo e si traduce in una risposta immunitaria mirata. Al contrario, quando l’attivazione delle cellule T è innescata da cellule dendritiche che presentano antigeni endogeni, porta a una risposta immunitaria difettosa e indesiderabile e provoca malattie autoimmuni.
Il team di ricercatori guidato dal Prof. Diefenbach ha scoperto che le cellule dendritiche non sono in grado di innescare risposte immunitarie in condizioni sterili (cioè nei topi privi di germi). I ricercatori hanno concluso che le cellule dendritiche devono ricevere informazioni mentre la cellula si trova nel suo stato basale, che è caratterizzato dall’assenza di infezione, e che queste informazioni devono derivare dal microbioma. Questi segnali derivati dal microbioma innescano ile cellule dendritiche per una futura risposta contro i patogeni.
“Vogliamo comprendere la natura degli effetti continui del microbioma sulla funzione delle cellule dendritiche”, afferma il Prof. Diefenbach. “In questo studio, siamo stati in grado di dimostrare che nel loro stato basale, queste cellule immunitarie specializzate sono soggette alla segnalazione ininterrotta controllata da microbiomi, di interferoni di tipo I (IFN-I)”.
Gli interferoni sono citochine, molecole di segnalazione speciali note per svolgere un ruolo nell’attività antivirale. “Fino ad ora, avevamo saputo solo poco del ruolo dell’IFN-I nello stato basale. Le cellule dendritiche che non ricevono questa segnalazione IFN-I durante lo stato basale non possono adempiere alle funzioni fisiologiche che svolgono nell’ambito della lotta del corpo contro i patogeni “, afferma il microbiologo. I risultati dello studio suggeriscono che il microbioma controlla l’idoneità del sistema immunitario. Esercita questo controllo portando il sistema immunitario in uno stato di “prontezza” al fine di accelerare la sua risposta ai patogeni.
I ricercatori hanno utilizzato vari modelli animali per ottenere informazioni sul modo in cui l’IFN-I controllato dai microbiomi premia le cellule dendritiche allo stato basale per i futuri combattimenti. Utilizzando la tecnologia di sequenziamento, i ricercatori sono stati in grado di confrontare gli epigenomi e i trascrittomi delle cellule dendritiche di animali privi di germi con quelli di animali di controllo e animali carenti di recettori IFN-I. I ricercatori volevano sapere cosa succede a livello molecolare nelle cellule dendritiche quando non sono più esposte all’IFN-I.
Descrivendo le osservazioni dei ricercatori, la prima autrice dello studio, Laura Schaupp, afferma: “È interessante notare che, quando abbiamo esaminato le cellule dendritiche da animali privi di germi e quelli senza segnalazione IFN-I, siamo stati in grado di osservare bassi livelli di espressione tra i geni coinvolti nella catena respiratoria mitocondriale. Ulteriori analisi hanno rivelato che il metabolismo cellulare delle cellule dendritiche da animali senza germi è disfunzionale, il che li rende incapaci di avviare una risposta immunitaria. Ciò suggerisce che il microbioma è di cruciale importanza per il funzionamento delle cellule dendritiche.
Le scoperte dei ricercatori possono contribuire allo sviluppo di nuovi approcci terapeutici. Molte malattie autoimmuni come il lupus eritematoso sistemico sono causate da una maggiore produzione di IFN-I. Altri studi hanno dimostrato che il microbioma influenza l’efficacia degli inibitori del checkpoint nelle immunoterapie del cancro. “Questi fenomeni continueranno a essere di grande interesse per noi”, afferma il Prof. Diefenbach. “Ad esempio, è possibile cambiare la composizione del microbioma in modo da ridurre la disponibilità di IFN-I, esercitando così un’influenza positiva sulle malattie autoimmuni? O potrebbe essere possibile migliorare le risposte alle immunoterapie del cancro esercitando un’influenza positiva sulla produzione IFN-I sottostante? ” Il team di ricercatori ora prevede di condurre ulteriori studi che esploreranno queste domande.