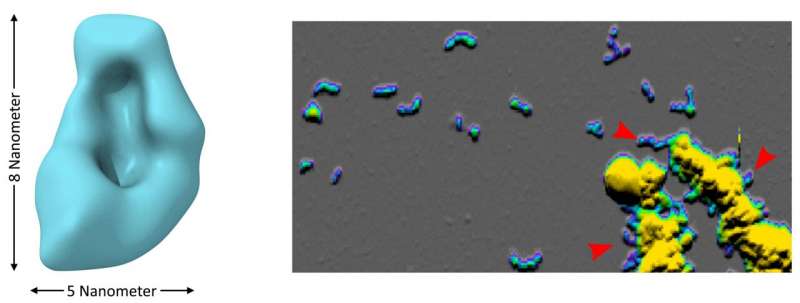
(Alzheimer-Immagine: i piccoli oligomeri di Aβ (a sinistra: microscopia crioelettronica) sono grumi costituiti da poche molecole di Aβ. Si raggruppano insieme per formare brevi strutture simili a vermi note come protofibrille (a destra: microscopia a forza atomica). In un ambiente acido, gli oligomeri Aβ si formano molto rapidamente e si raggruppano per formare particelle di grandi dimensioni da cui vengono separate le protofibrille dopo la neutralizzazione del valore del pH (frecce rosse a destra). Credito: Forschungszentrum Jülich, HHU Düsseldorf / Wolfgang Hoyer).
Si sospetta che piccoli aggregati di proteine noti come oligomeri Aβ siano la causa principale dello sviluppo della malattia di Alzheimer. Tuttavia, non è ancora chiaro dove e in quali condizioni si formino questi aggregati tossici.
I ricercatori dell’Università Heinrich Heine di Düsseldorf e del Forschungszentrum Jülich, insieme ai partner dell’Università e dell’Ospedale Universitario di Colonia, hanno scoperto che un ambiente leggermente acido favorisce questo sviluppo. In questo ambiente, gli oligomeri si formano circa 8.000 volte più velocemente rispetto a un pH neutro, come scrivono gli scienziati sulla rivista Nature Communications. Un pH così leggermente ridotto si può trovare anche in alcune sottostrutture delle cellule nervose.
Le cause precise della malattia di Alzheimer devono ancora essere completamente comprese nonostante un’intensa ricerca. Per decenni, ci si è concentrati sui caratteristici depositi proteici nel cervello dei malati di Alzheimer che possono essere visti chiaramente con un microscopio. Oggi i ricercatori si concentrano invece sui “parenti minori” di questi giacimenti, gli oligomeri. Questi sono anche accumuli del peptide beta-amiloide (Aβ), ma su scala molto più piccola tipicamente comprendente solo poche unità.
Aβ non è dannoso di per sé e può essere trovato anche in individui sani. Tende ad assemblarsi in strutture tossiche quando, ad esempio, i processi metabolici vengono interrotti nel cervello. I processi biochimici che attivano questi oligomeri tossici sono visti come la causa della malattia di Alzheimer. Tuttavia, non è chiaro dove e come si formino questi oligomeri. In vitro, non è stato ancora possibile replicare il processo in condizioni realistiche. Le quantità di Aβ necessarie per farlo sono considerevolmente superiori a quelle che possono essere rilevate nel fluido cerebrale.
Nello studio ora pubblicato, i ricercatori sono stati in grado di dimostrare che lo sviluppo degli oligomeri dipende molto dal valore del pH. In condizioni leggermente acide, si formano 8.000 volte più velocemente rispetto a un valore di pH neutro. Tali condizioni si possono trovare, ad esempio, in alcune sottostrutture di cellule note come endosomi e lisosomi, piccole bolle o vescicole che svolgono un ruolo centrale nel trasporto e nella degradazione delle sostanze nella cellula.
“Le quantità di Aβ presenti in queste regioni cellulari sono quindi sufficienti per consentire la formazione di oligomeri di Aβ“, spiega Wolfgang Hoyer dell’Università Heinrich Heine di Düsseldorf e del Forschungszentrum Jülich.
Endosomi e lisosomi sono stati a lungo un punto focale della ricerca sull’Alzheimer. Questi sono i siti in cui le singole molecole di Aβ si sviluppano in primo luogo attraverso la scomposizione di una proteina precursore. Sono anche punti di raccolta verso i quali viene trasportato l’Aβ assorbito dalla cellula. “I nostri risultati ora indicano che endosomi e lisosomi sono anche i siti in cui si formano preferenzialmente gli oligomeri Aβ“, spiega Hoyer.
Vedi anche:Alzheimer: dubbi sulla teoria prevalente
Lo studio fornisce spiegazioni per la cattiva distribuzione delle proteine
I ricercatori sono stati anche in grado di stabilire un legame tra gli oligomeri tossici di Aβ e un’altra caratteristica del morbo di Alzheimer. Dopo aver aggiunto gli oligomeri Aβ, hanno osservato un’errata distribuzione della proteina tau all’interno delle cellule nervose. La proteina tau è una seconda proteina strettamente legata all’andamento della malattia di Alzheimer. La sua presenza in posizioni sbagliate può portare a interruzioni dell’attività e della struttura delle cellule nervose.
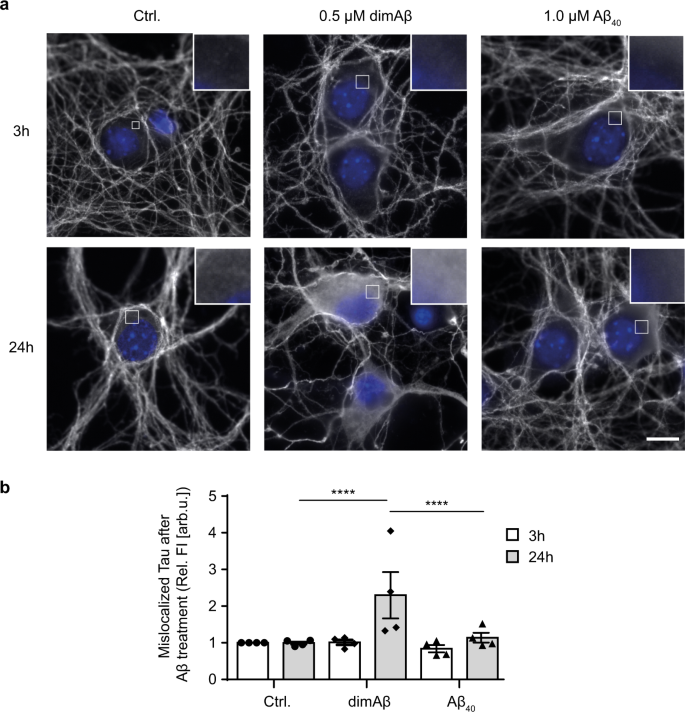
Fig. 3: DimAβ AβOs inducono il missorting somatodendritico patologico di Tau.
“La maldistribuzione e altri cambiamenti patologici della proteina tau sono fondamentali per la perdita di funzione delle cellule nervose e i disturbi cognitivi dei malati di Alzheimer. Il fatto che gli oligomeri Aβ qui descritti possano innescare questo cambiamento patologico della proteina tau nelle cellule nervose sottolinea l’elevata rilevanza fisiopatologica dello studio“, spiega Hans Zempel dell’Ospedale universitario di Colonia.
Il team di ricercatori è stato anche in grado di studiare la dimensione e la forma degli oligomeri mediante microscopia crioelettronica e microscopia a forza atomica. “I risultati ottenuti forniscono una base per ottenere una migliore comprensione delle proprietà speciali e dell’impatto di questi aggregati proteici critici”, afferma Hoyer. Ciò contribuirà allo sviluppo di strategie di diagnosi e trattamento mirate specificamente agli oligomeri.