Le metastasi, la migrazione delle cellule tumorali dal loro sito primario, sono associate a una prognosi sfavorevole. Una molecola, prodotta durante il metabolismo cellulare, limita lo sviluppo delle metastasi, rivelando che questo metabolita limita la progressione del cancro.
Il cancro diventa letale quando le cellule tumorali si diffondono dal loro sito primario nel corpo per invadere organi distanti – un processo chiamato metastasi. Perché si verifichi questo evento complesso, le cellule devono invadere il loro tessuto circostante, entrare nel flusso sanguigno e colonizzare un’altra posizione, dove si formano tumori secondari chiamati metastasi. Molte delle prime fasi della metastasi, inclusa la migrazione cellulare, possono essere indotte dall’attivazione anormale di un normale programma di sviluppo chiamato transizione epiteliale-mesenchimale (EMT), in cui le cellule epiteliali che rivestono le superfici corporee assumono le caratteristiche delle cellule mesenchimali, che hanno proprietà migratorie. Nell’articolo pubblicato su Nature, Wang et al. identificano un meccanismo precedentemente sconosciuto per mezzo del quale una molecola generata nel metabolismo cellulare inibisce l’induzione di EMT e quindi limita le metastasi del carcinoma polmonare nei topi.
Le molecole formate durante il metabolismo possono avere un ruolo chiave nel supportare la sopravvivenza, la proliferazione e le metastasi delle cellule tumorali. Le cellule tumorali hanno un livello di assorbimento dei nutrienti superiore al normale. Quando le cellule tumorali migrano nel flusso sanguigno, avvertono stress cellulare. Ciò è caratterizzato da un aumento delle molecole chiamate specie reattive dell’ossigeno e le alterazioni metaboliche che contrastano tale stress possono favorire la metastasi. Ma se le vie metaboliche influenzano altri aspetti delle metastasi non è stato ancora ben compreso.
Per indagare ulteriormente su questo, Wang e colleghi hanno bloccato individualmente l’espressione di 111 enzimi metabolici nelle cellule tumorali polmonari umane che erano sorte dalle cellule epiteliali. Utilizzando queste cellule coltivate in vitro, gli autori hanno scoperto che l’inibizione della produzione dell’enzima UGDH ha compromesso la capacità migratoria delle cellule. UGDH converte il glucosio UDP (UDP-Glc) in acido glucuronico UDP (UDP-GlcUA), necessario per produrre molecole di polisaccaridi come l’acido ialuronico, un componente del materiale della matrice extracellulare nei tessuti in cui risiedono le cellule epiteliali. L’acido ialuronico può attivare i recettori sulla superficie delle cellule per avviare l’EMT e il suo accumulo nei tumori è spesso associato a scarsi risultati clinici.
Sorprendentemente, quando gli autori hanno inibito l’espressione di UGDH, la migrazione cellulare non è stata compromessa a causa della riduzione dei livelli di UDP-GlcUA o acido ialuronico, ma a causa di un accumulo di UDP-Glc. Poiché EMT nelle cellule tumorali è associato ad un aumento della loro migrazione, gli autori hanno studiato se UDP-Glc ha un effetto sull’induzione dell’EMT. Hanno scoperto che l’esaurimento di UGDH, e quindi l’accumulo di UDP-Glc, è stato accompagnato da una diminuzione della stabilità dell’RNA messaggero che codifica per una proteina del fattore di trascrizione chiamata SNAIL. Questo fattore di trascrizione regola l’espressione dei geni associati a EMT. Quando gli autori hanno progettato le cellule tumorali in modo da produrre SNAIL, le cellule migravano anche quando l’UGDH era esaurito. Questi risultati indicano che UGDH agisce in un percorso che regola la migrazione cellulare (Fig. 1).
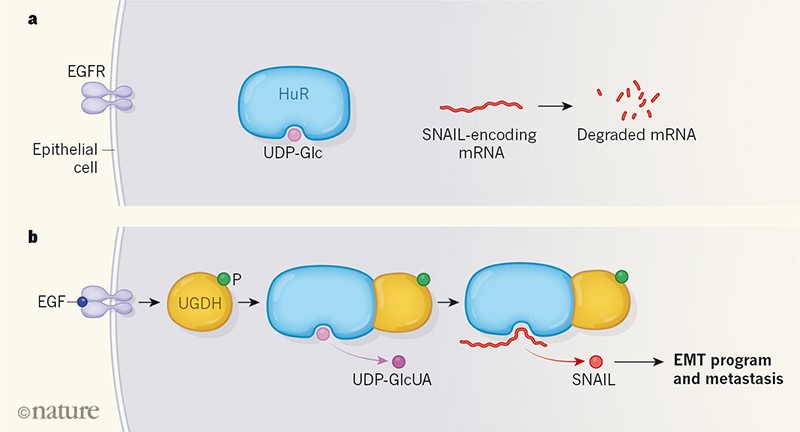
Immagine: Figura 1 | A molecule formed during cellular metabolism hinders cancer-cell migration.
In che modo un enzima metabolico come l’UGDH può influenzare la stabilità dell’mRNA?
Gli autori si sono concentrati su HuR, una proteina che si lega e stabilizza gli obiettivi di mRNA6, inclusa la trascrizione che codifica per SNAIL. Hanno scoperto che UDP-Glc si lega direttamente a HuR, impedendo così alla proteina di interagire con l’mRNA che codifica SNAIL. Gli autori hanno progettato una forma di HuR che aveva mutazioni nei residui di aminoacidi previsti per coordinare il suo legame con UDP-Glc. Rispetto alle cellule che presentavano HuR di tipo normale, si è scoperto che quelli con la forma mutante avevano maggiori probabilità sia di formare metastasi nei topi sia di migrare in vitro attraverso una membrana in un piatto di coltura.
Ciò suggerisce che un’interazione tra UDP-Glc e HuR impedisce a HuR di agire in un percorso per indurre programmi cellulari che promuovono la metastasi. Quando gli autori hanno iniettato cellule tumorali nei topi e hanno somministrato UDP-Glc ad alcuni di essi, quelli che hanno ricevuto UDP-Glc avevano meno metastasi rispetto agli animali che non lo avevano ricevuto.
I risultati dello studio si aggiungono alla crescente evidenza che i metaboliti possono influenzare i programmi di espressione genica.
Gli esempi più noti di questo sono casi in cui i metaboliti forniscono substrati per gli enzimi che regolano l’espressione genica modificando i gruppi chimici attaccati al DNA o alle proteine dell’istone che si legano al DNA. Tuttavia, UDP-Glc influenza invece l’espressione genica prevenendo fisicamente l’interazione tra una proteina e mRNA. In che modo UDP-Glc influisce specificamente sull’interazione di HuR con l’mRNA con codifica SNAIL, senza comprometterne l’interazione con altri mRNA, è una domanda aperta. Dati i collegamenti tra espressione SNAIL, EMT e matrice extracellulare, si è tentati di ipotizzare che accoppiare la produzione di SNAIL ai metaboliti che generano acido ialuronico potrebbe essere un modo efficace per coordinare i cambiamenti sia nel metabolismo che nella produzione di proteine necessarie per promuovere metastasi.
Pertanto, a differenza dei metaboliti che si accumulano attraverso le mutazioni associate al cancro negli enzimi metabolici e promuovono la progressione tumorale, UDP-Glc limita la progressione. Questa scoperta allarga i nostri orizzonti riguardo ai modi in cui i metaboliti possono influenzare il cancro. Sebbene sia stato a lungo riconosciuto che i profili metabolici delle cellule tumorali differiscono da quelli delle cellule normali, stiamo solo iniziando ad apprezzare la complessità delle alterazioni metaboliche coinvolte nella crescita del tumore.