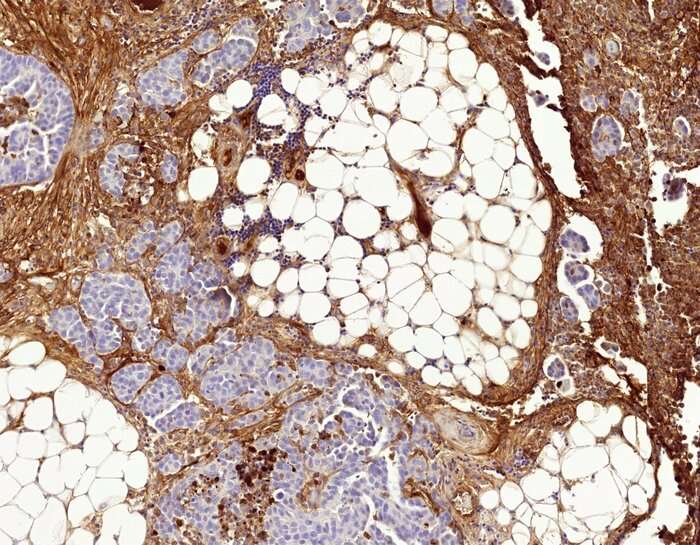
(Tumore-Immagine: cellule tumorali ovariche sopravvissute (nucleo azzurro) circondate da tessuto fibrotico. Credito: Elina Pietilä, Università di Helsinki).
Le cellule tumorali a volte sviluppano resistenza ai farmaci citotossici utilizzati nella chemioterapia. È quindi importante capire perché il trattamento non funziona.
“Non abbiamo capito molto su come si sviluppa questa resistenza alla chemioterapia e ancor meno su come il microambiente nel cancro può influenzare il processo”, afferma Kaisa Lehti, Professore presso il Dipartimento di biomedicina dell’Università norvegese di scienza e tecnologia (NTNU). Lehti ha guidato il lavoro per capire di più su come i tessuti cancerosi sviluppano resistenza a una particolare forma di chemioterapia. L‘Università di Helsinki, Karolinska Institutet e NTNU hanno collaborato alla ricerca. I risultati sono stati ora pubblicati sulla rinomata rivista Nature Communications.
Il trattamento standard del tumore potrebbe fallire
Il cancro ovarico colpisce circa 500 donne norvegesi ogni anno. Se il cancro viene diagnosticato precocemente, quasi tutte le pazienti sopravvivono ai primi cinque anni. Ma se viene scoperto in seguito, le possibilità di sopravvivenza sono peggiori. Trovare un trattamento efficace è quindi molto importante.
Uno dei trattamenti standard per il cancro ovarico è chiamato chemioterapia al platino. Le citotossine sono così chiamate perché contengono composti di platino. Sono spesso efficaci nel trattamento di vari tipi di cancro. Sfortunatamente, le cellule tumorali spesso sviluppano resistenza a questo particolare trattamento chemioterapico al platino. La soluzione sta nel modo in cui la citotossina stessa può modificare le cellule cancerose e il loro ambiente.
Vedi anche:Cancro e chemioterapia accelerano l’invecchiamento
La citotossina cambia le cellule del tumore e l’ambiente
Lehti riassume il processo: “La citotossina può cambiare il modo in cui le cellule tumorali inviano e percepiscono i segnali e può modificare il microambiente intorno alle cellule”. Questo cambiamento consente alle cellule tumorali di resistere ai danni causati dalla citotossina e possono quindi sopravvivere all’attacco chemioterapico. I ricercatori hanno trovato questa chiave del puzzle in uno strato di tessuto che spesso circonda le cellule tumorali. “Una rete fibrotica di proteine, nota come matrice extracellulare o ECM, circonda le cellule tumorali, in particolare quelle più aggressive”, afferma Lehti.
Il tessuto fibrotico si forma quando il corpo cerca di riparare una lesione. Il tessuto fibrotico, con la rete ECM attorno alle cellule tumorali, è prodotto principalmente dalle normali cellule del tessuto connettivo. Ma le cellule cancerose e le cellule del tessuto connettivo nella rete possono alterare questo tessuto da sole. “In precedenza, non sapevamo come la comunicazione tra le cellule tumorali e la matrice extracellulare sia influenzata o addirittura influenzi se stessa, lo sviluppo del cancro e la sua risposta alla chemioterapia”, afferma Lehti. “Ma ora ne sappiamo di più. È già noto che i segnali chimici e meccanici nel tessuto ECM circostante aiutano il cancro a sviluppare la sua capacità di diffondersi e di resistere al trattamento. Alcuni segnali dall’ECM possono modificare in modo critico la resistenza delle cellule tumorali ai farmaci citotossici a base di platino“, spiega la professoressa Kaisa Lehti.
La citotossina può quindi aiutare a modificare sia il microambiente intorno alle cellule tumorali sia la capacità delle cellule tumorali di ricevere e percepire segnali nell’ambiente che le aiutano a resistere alla citotossina. Ciò può causare il mancato funzionamento della citotossina.
Spiegano gli autori:
“Il carcinoma sieroso di alto grado (HGSC) è la forma più comune di cancro ovarico (OC) e la malattia ginecologica più letale. I pazienti con HGSC sono spesso diagnosticati in uno stadio avanzato, con liquido di ascite maligna e metastasi ampiamente diffuse accumulate all’interno della cavità peritoneale e degli organi. L’attuale standard di cura si basa sulla citoriduzione chirurgica e sulla chemioterapia a base di platino, ma nonostante una buona risposta iniziale al regime, oltre il 70% dei pazienti sviluppa una resistenza al platino entro 5 anni e questo porta a una breve aspettativa di vita.
Disseminati dall’ovaio o dalle tube di Falloppio, gli sferoidi HGSC multicellulari si accumulano nell’ascite e si diffondono per via intraperitoneale all’interno del rivestimento della cavità addominale e nei tessuti viscerali, in particolare nell’omento. La metastasi all’omento determina una trasformazione del tessuto, composto principalmente da adipociti, in un micro ambiente tumorale (TME) fibrotico ricco di matrice extracellulare detta anche desmoplasia, istologicamente priva di adipociti. L’ECM specifico e le firme di rimodellamento del collagene nel carcinoma sieroso di alto grado (HGSC) si associano alla rigidità del tumore e all’estensione dell’area desmoplastica indicata come punteggio di malattia elevato, nonché metastasi e scarsa sopravvivenza. Oltre ad alterare le cellule tumorali, la chemioterapia colpisce lo stroma tumorale, compresa l’induzione di fibrosi densa e infiammazione. Tuttavia, le alterazioni indotte dalla chemioterapia nel matrisoma e la relazione tra questi cambiamenti e le risposte cellulari, che potrebbero far luce sui processi di chemioresistenza e recidiva dell’HGSC, non sono ancora state sistematicamente identificate. Per capire come l’ECM co-evolve con le funzioni delle cellule tumorali nelle metastasi e nella chemioresistenza dell’HGSC, abbiamo condotto un’analisi trascrittomica completa utilizzando una coorte HGSC longitudinale di siti anatomici distinti prima e dopo la chemioterapia. Accoppiato con esperimenti funzionali che valutano gli effetti dell’ECM e la rigidità nelle chemio-risposte delle cellule tumorali, mostriamo qui che, nelle cellule HGSC che sfuggono al trattamento, il platino induce l’adesione, la diffusione e la migrazione delle cellule in un modo dipendente sia dalla composizione della proteina ECM che dalla rigidità. I nostri dati, inclusa la sovraregolazione del collagene 6 promotore del tumore dipendente dalla rigidità (COL6), descrivono come le metastasi e i cambiamenti indotti dalla chemioterapia forniscono nicchie uniche per le cellule tumorali per impegnarsi nel rimodellamento e rilevamento alterati della ECM)“.
La maggiore conoscenza di questi meccanismi è utile quando si scelgono trattamenti per le persone con cancro.
Fonte:Nature