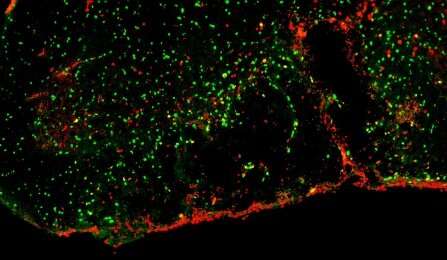
(Sclerosi multipla-Immagine: l’ambiente del tessuto infiammato dopo la demielinizzazione impedisce il reclutamento delle cellule progenitrici degli oligodendrociti (OPC) (verde) e ne arresta la divisione (rosso). Questo può essere superato con il trattamento con PI-88, un modulatore dell’eparanoma. Credit: Darpan Saraswat).
Due articoli dei ricercatori dell’Università di Buffalo rivelano importanti nuove scoperte su come la rigenerazione della mielina nella sclerosi multipla fallisca e, potenzialmente, modi più efficienti per trattarla. I risultati dello studio includono la prima dimostrazione che un farmaco esistente, attualmente in fase di studio come terapia contro il cancro, può alterare le cascate di segnalazione chiave che provocano la SM.
Pubblicata nel Journal of Neuroscience e in Nature Communications, la ricerca preclinica sui modelli murini di SM riporta la scoperta di un singolo target farmacologico che può influenzare più percorsi contemporaneamente, potenzialmente interferendo con le molteplici cause della SM con un singolo farmaco.
Vedi anche:Sclerosi multipla recidivante: approvato Ponvory dalla FDA
La matrice (extracellulare)
I risultati della UB sottolineano il ruolo significativo che la matrice extracellulare gioca nel causare la demielinizzazione nel cervello, che è un segno distintivo della SM. Descritta come una sorta di impalcatura non cellulare per tutti i tessuti e gli organi, la matrice extracellulare svolge un ruolo vitale nell’avvio di molte cascate di segnalazione biochimiche e tessuto-specifiche critiche. Nel cervello, questo include i responsabili della regolazione della riparazione della mielina, l’isolante grasso che mantiene i neuroni in comunicazione. Il ruolo della matrice extracellulare è sempre più apprezzato come una variabile chiave nella SM che può determinare se si verificherà o meno la rimielinizzazione dopo che è stata danneggiata.
“Nella sclerosi multipla, è noto da tempo che la cicatrizzazione dei tessuti – letteralmente, la sclerosi della SM – è una caratteristica patologica chiave e che l’ambiente, la matrice extracellulare, orchestra la segnalazione che supporta o ostacola i processi di riparazione e rigenerazione dei tessuti, “ha detto Fraser Sim, Ph.D., autore senior di entrambi gli articoli, Professore associato di farmacologia e tossicologia presso la Jacobs School of Medicine e Scienze biomediche presso la UB e Direttore del programma di neuroscienze. Darpan Saraswat, Ph.D., ricercatore senior nel laboratorio di Sim, è il primo autore di entrambe le pubblicazioni.
“In malattie come la SM”, ha spiegato Sim, “la matrice extracellulare subisce un profondo cambiamento. Questi cambiamenti alterano le interazioni tra le cellule contribuendo a un fallimento della riparazione o rimielinizzazione della mielina“.
La ricerca della UB si è concentrata sugli enzimi chiave coinvolti nella regolazione dell’eparina solfatazione che svolge un ruolo chiave nella segnalazione tra le cellule. In particolare, i ricercatori hanno studiato quale ruolo gioca l’eparanoma nella rimielinizzazione. “L’eparanoma”, ha spiegato Sim, “si riferisce alla natura altamente complessa di come l’eparina solfato, un polimero di carboidrati che viene modificato dalla solfatazione in un modo molto specifico, appare sulla superficie di una cellula. L’eparanoma contribuisce all’ambiente della matrice extracellulare e regola l’attività di più cascate di segnalazione per influenzare il comportamento e la funzione delle cellule nello sviluppo e nella malattia”, ha detto Sim. Ha aggiunto che l’eparanoma regola una serie di cascate di segnali vitali che regolano sia la riparazione della mielina che la biologia delle cellule progenitrici degli oligodendrociti (OPC), le cellule che generano la mielina.
Nel documento di Nature Communications, Sim e i suoi colleghi mostrano che SULF2, uno degli enzimi coinvolti nella regolazione dell’eparan solfatazione, è altamente espresso dagli oligodendrociti. “Nei pazienti con SM”, ha detto il ricercatore, “si trova ad alti livelli nelle regioni di demielinizzazione e probabilmente esercita una profonda influenza sull’ambiente dei tessuti malati. Abbiamo scoperto che quando abbiamo eliminato geneticamente SULF2 dagli oligodendrociti, si è ottenuta una rimielinizzazione accelerata attraverso un migliore reclutamento e differenziazione degli oligodendrociti “, ha affermato Sim.
I ricercatori hanno anche scoperto che un agente farmacologico chiamato PI-88, attualmente in sperimentazione clinica come agente contro vari tumori, blocca SULF2 ed è in grado di accelerare il reclutamento degli oligodendrociti nelle regioni di demielinizzazione e promuovere la rigenerazione di nuovi oligodendrociti e mielina.
Alterazione dell’eparanoma
I ricercatori hanno continuato il loro studio su PI-88 pubblicato dal Journal of Neuroscience, esaminando la sua capacità di alterare l’eparanoma nel contesto di un ambiente tissutale altamente infiammato. Hanno scoperto che PI-88 potrebbe migliorare la rimielinizzazione anche dopo che il processo di riparazione mediato dagli OPC è stato interrotto dall’infusione della citochina proinfiammatoria interferone-g, che si traduce nella demielinizzazione cronica e nella degenerazione assonale che è un segno distintivo delle forme progressive di SM.
Sim e i suoi colleghi hanno recentemente ricevuto una sovvenzione del Dipartimento della Difesa che permetterà loro di continuare a esplorare PI-88 come potenziale trattamento per la SM.
“Queste due pubblicazioni evidenziano un ruolo nuovo dell’eparanoma nella regolazione della rimielinizzazione“, ha detto Sim. La ricerca suggerisce che molecole come PI-88, che possono alterare sia l’equilibrio della produzione di eparin solfato che la solfatazione complessiva, sono bersagli interessanti per le terapie rigenerative nella SM e in altre malattie demielinizzanti.
Un bersaglio come l’eparanoma, che influenza tanti aspetti del comportamento e della funzione cellulare, fornisce un approccio efficiente per affrontare i molteplici percorsi coinvolti nella demielinizzazione della SM.
“La nostra caratterizzazione del ruolo dell’eparanoma nella SM e la scoperta che è possibile modularlo con una piccola molecola potente, sono prove incoraggianti che potremmo essere rilevanti nel contesto della scoperta di farmaci”, ha detto Sim.
Fonte:The Journal of Neuroscience