Il modo convenzionale di classificare i tumori metastatici in base al loro organo di origine nega alle persone l’accesso ai farmaci che potrebbero aiutarle.
Nel secolo scorso, i due principali approcci al trattamento delle persone affette da cancro – la chirurgia e le radiazioni – si sono concentrati sulla sede del tumore nel corpo. Ciò ha portato gli oncologi medici e altri operatori sanitari, le agenzie di regolamentazione, le compagnie assicurative, le aziende farmaceutiche – e i pazienti – a classificare i tumori in base all’organo in cui hanno avuto origine. Tuttavia esiste una crescente disconnessione tra la classificazione dei tumori in questo modo e gli sviluppi nell’oncologia di precisione, che utilizza la profilazione molecolare delle cellule tumorali e immunitarie per guidare le terapie.
Più di dieci anni fa, ad esempio, alcuni ricercatori negli Stati Uniti hanno dimostrato in uno studio clinico che il farmaco Nivolumab potrebbe migliorare gli esiti in alcuni individui affetti da cancro. Nello studio – che includeva persone con diversi “tipi” di cancro (come convenzionalmente definiti), dal melanoma al cancro del rene, Nivolumab ha ridotto i tumori di alcune persone di oltre il 30%, ma ha avuto poco o nessun effetto sui tumori di altri tipi.
Nivolumab ha come target PD1. Si tratta di un recettore di una proteina chiamata PD-L1, che aiuta le cellule tumorali a sfuggire all’attacco del sistema immunitario. Dei 236 partecipanti allo studio i cui tumori potevano essere valutati, 49 hanno risposto positivamente al trattamento. Il fattore determinante era se le loro cellule tumorali esprimessero alti livelli di PD-L1.
Il passo logico successivo sarebbe stato quello di condurre studi clinici che testassero gli effetti di Nivolumab e di altri inibitori di PD1 in persone con tumori metastatici che esprimono fortemente PD-L1, indipendentemente dall’organo in cui il cancro aveva avuto origine. Ma a causa del modo in cui i tumori vengono classificati come al seno, ai reni, ai polmoni e così via, i ricercatori hanno dovuto condurre studi clinici in sequenza per ciascun tipo di malattia.
Per circa un decennio, milioni di persone con tumori che esprimevano alti livelli di PD-L1 non hanno potuto accedere ai farmaci pertinenti perché non erano ancora stati condotti studi per il loro tipo di cancro quando si sono ammalati. Quelli con determinati tumori al seno o ginecologici che esprimevano PD-L1 hanno dovuto attendere 7-10 anni per accedere agli inibitori di PD1.
Una storia simile si è verificata con la maggior parte dei farmaci testati negli studi clinici negli ultimi dieci anni. Questi includono gli inibitori PARP, che uccidono le cellule tumorali portatrici di mutazioni nei geni del cancro al seno BRCA1 e BRCA2. È ormai noto che queste mutazioni si verificano in molteplici “tipi” di tumore come convenzionalmente definiti (vedi “Perdere vite umane”), non solo nei tumori al seno.
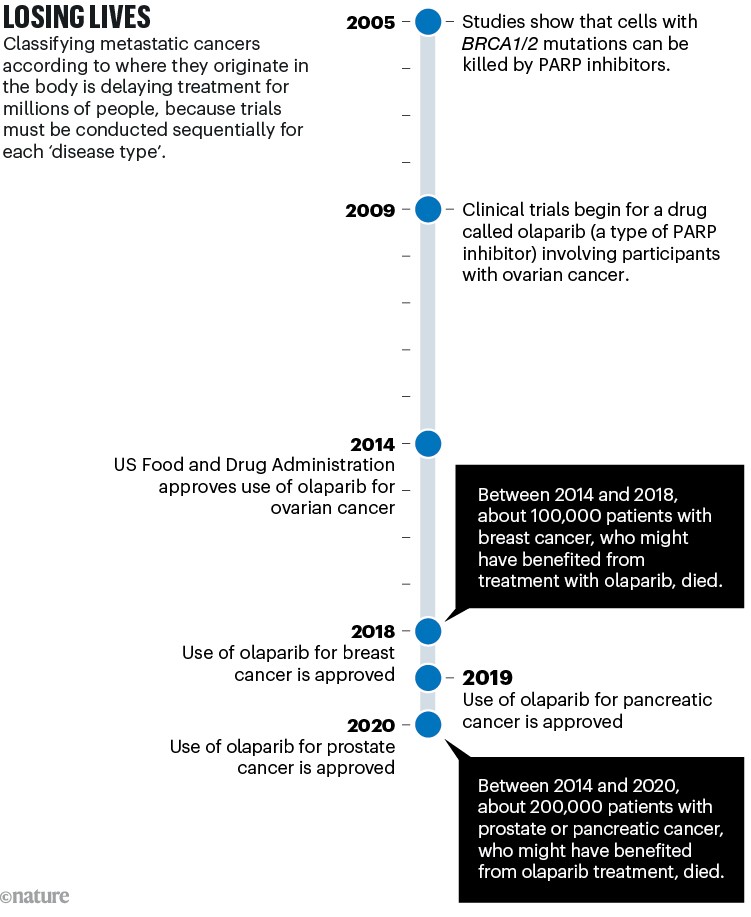
Fonte: Nature.com/3SHNTEJ
I tumori metastatici (quelli che si sono diffusi oltre l’organo da cui hanno avuto origine) rappresentano circa il 67-90% dei decessi per cancro e sono quasi sempre trattati a livello sistemico, ovvero con farmaci che entrano nel flusso sanguigno. Per migliorare i trattamenti per le persone con cancro metastatico, la comunità deve urgentemente passare dall’uso delle classificazioni del cancro basate sugli organi a quelle molecolari. Ciò richiederà cambiamenti radicali nel modo in cui l’oncologia medica è strutturata, condotta e insegnata.
Abitudini di un secolo
In Francia e in alcuni altri paesi europei, i pazienti non vengono rimborsati se assumono farmaci che sono stati testati in studi in cui i tumori non sono definiti dall’organo da cui hanno avuto origine. Nel frattempo, la maggior parte delle Organizzazioni scientifiche in oncologia, come l’American Society of Clinical Oncology e la European Society of Medical Oncology (ESMO), organizzano i loro incontri e pubblicano le loro linee guida in base all’organo di origine. E negli ultimi dieci anni, i Centri oncologici e le Università hanno trasformato l’oncologia in molteplici sottospecialità organo-specifiche. Gli Ospedali hanno reparti per il cancro al seno, reparti per il cancro ai polmoni e così via; agli studenti di medicina vengono offerti moduli in materie come gastroenterologia e pneumologia; e la ricerca preclinica, le sperimentazioni cliniche e i protocolli di trattamento sono spesso adattati alle specialità organo-specifiche.
Questo attaccamento a classificare il cancro – e ad affrontarlo – sulla base dell’organo da cui ha avuto origine sta bloccando il progresso in molteplici modi.
In primo luogo, va contro la comprensione scientifica che sta emergendo oggi.
Gli ultimi due decenni di ricerca sul cancro, dominati dagli sforzi per caratterizzare i tumori a livello cellulare e molecolare, hanno dimostrato che alcuni degli eventi molecolari che guidano la loro evoluzione sono condivisi tra diversi “tipi” di cancro. Le mutazioni nel gene soppressore del tumore TP53 , ad esempio, sono una caratteristica della maggior parte dei tipi di cancro, come definito dall’organo in cui il cancro ha avuto origine. Inoltre, la maggior parte dei tipi di cancro può essere suddivisa in diversi sottogruppi molecolari. Alcuni tumori polmonari presentano mutazioni nel gene del recettore del fattore di crescita epidermico (EGFR), alcuni presentano mutazioni nel gene MET, altri presentano traslocazioni che coinvolgono il gene ALK e così via.
In secondo luogo – come già descritto – classificare il cancro in base all’organo da cui ha avuto origine sta rendendo più difficile per i pazienti ottenere i farmaci che potrebbero aiutarli. Infatti, quando si tratta di approvare l’uso dei trattamenti da parte degli enti regolatori, è probabile che le classificazioni su base molecolare diventino sempre più importanti man mano che sempre più farmaci vengono sviluppati utilizzando biotecnologie avanzate.
I medici possono identificare bersagli molecolari nei singoli tumori e decidere i trattamenti. Credito: Gustave Roussy
I coniugati di farmaci anticorpali, ad esempio, sono anticorpi che prendono di mira le proteine di membrana espresse da diversi tipi di cancro per fornire la chemioterapia alle cellule tumorali. Il farmaco anticorpo coniugato trastuzumab deruxtecan si è già dimostrato promettente negli studi di fase I e di fase II nel trattamento di pazienti i cui tumori sovraesprimono il gene HER2 o ne presentano una versione mutata, indipendentemente dall’organo in cui ha avuto origine il cancro.
Infine, l’approccio convenzionale alla classificazione del cancro sta ostacolando l’educazione medica e la comprensione del paziente.
Attualmente, studenti e professionisti devono memorizzare e digerire una quantità enorme di informazioni; ogni anno vengono pubblicati circa 10.000 articoli scientifici che includono le parole “cancro” e “sperimentazione randomizzata”. L’implementazione di una classificazione su base molecolare renderebbe più facile l’apprendimento per studenti e medici. Gli studenti non avrebbero bisogno di memorizzare i risultati degli studi clinici condotti per ciascun tipo perché gli studi verrebbero condotti su tutti i tipi di cancro. Inoltre, la conoscenza dei meccanismi molecolari alla base della malattia renderebbe più facile per gli studenti ricordare i risultati degli studi clinici.
Prendiamo, ad esempio, una famiglia di enzimi chiamati PI3K, che sono coinvolti in processi cellulari come la crescita e la proliferazione cellulare. Dopo che a uno studente viene insegnato che questi sono coinvolti nella regolazione dei livelli di glucosio, dovrebbe essere più facile per lui ricordare che gli inibitori PI3K – che sono usati per trattare alcune persone con cancro al seno – possono portare a iperglicemia (alti livelli di zucchero nel sangue). Ciò significa che alle persone con diabete i medici non dovrebbero somministrare questi farmaci o, se lo fanno, dovrebbero attentamente monitorare i livelli di zucchero nel sangue.
Il modo per cambiare
Dal primo studio su Nivolumab nel 2012, le cose hanno iniziato a muoversi in una direzione migliore, in particolare quando si tratta di agenzie di regolamentazione che approvano farmaci focalizzati sull’esistenza di un bersaglio molecolare piuttosto che sull’organo di origine del cancro.
Nel 2017, la Food and Drug Administration (FDA) statunitense ha approvato l’uso di un farmaco chiamato Pembrolizumab per trattare le persone che hanno cellule tumorali con un deficit nel sistema di riparazione del disadattamento del DNA, indipendentemente dall’organo da cui ha avuto origine il cancro. L’agenzia ha stabilito che Pembrolizumab potrebbe essere utilizzato anche per trattare persone le cui cellule tumorali presentano un numero elevato di mutazioni rispetto alle cellule sane e ad altre cellule tumorali. E negli anni successivi ha approvato l’uso di numerosi altri farmaci per il trattamento del cancro sulla base dei bersagli biologici dei farmaci.
Tuttavia, è necessario un cambiamento di mentalità molto maggiore da parte degli altri regolatori e della comunità del cancro in generale. Per far sì che ciò accada sarà necessario agire diversamente su almeno quattro fronti.
Migliorare orientamenti e metodologie
Le agenzie di regolamentazione, le società scientifiche e le compagnie di assicurazione devono definire meglio quali prove precliniche e cliniche siano necessarie per determinare se, quando si tratta di trattamento, una specifica alterazione molecolare debba avere la priorità rispetto all’organo in cui ha avuto origine il cancro.
Alcune società scientifiche, come l’ESMO, stanno già sviluppando linee guida. E la FDA sta lavorando per definire quando un farmaco può essere approvato sulla base di un marcatore molecolare, indipendentemente dall’organo da cui ha avuto origine il cancro.
Cura personalizzata
Nei prossimi anni e decenni, numerosi strati di informazioni potrebbero essere incorporati in caratterizzazioni complete del cancro che siano uniche per ciascun paziente.
Questi includono l’organo d’origine del cancro, che talvolta rimane un fattore importante nel decidere quale trattamento provare; il numero e la dimensione dei tumori e la loro aggressività, misurata dai livelli di espressione di alcuni geni. Tra le altre informazioni potenzialmente utili c’è l’analisi genetica del DNA germinale di una persona, che può fornire informazioni sulla sua sensibilità a determinati farmaci o sulla possibilità di sperimentare effetti collaterali dannosi e la salute generale dei pazienti, monitorata dai livelli di affaticamento, perdita di peso e così via.
Classificare i tumori in base alle loro caratteristiche molecolari accelererebbe l’accesso di milioni di persone a trattamenti efficaci; è anche il primo passo verso l’oncologia di precisione e una comprensione biologica più profonda del funzionamento del cancro.
Fonte: Nature