Cancro-Immagine credit public domain.
Cresce l’interesse per i trattamenti PROTAC che eliminano le proteine che causano malattie, comprese quelle responsabili dei tumori infantili difficili da curare.
A tre anni, a Evan Lindberg fu diagnosticato un neuroblastoma, un tumore infantile che si sviluppa nel tessuto nervoso esterno al cervello. A quel punto, i tumori si erano già diffusi in tutto il suo piccolo corpo. Seguirono chemioterapia, radioterapia, immunoterapia e diversi interventi chirurgici. “Per quattro anni, mio figlio non ha mai avuto un giorno di riposo“, racconta il padre di Evan, Gavin. “O era in cura o in fase di recupero. E spesso la fase di recupero era peggiore della cura”. Evan morì nel 2010 all’età di sette anni.
Uno dei medici di Evan, l’oncologa pediatrica Yael Mossé del Children’s Hospital di Philadelphia, in Pennsylvania, è da tempo alla ricerca di opzioni terapeutiche migliori. Lavora sul neuroblastoma da oltre vent’anni, eppure, nonostante i piccoli progressi, “abbiamo fatto davvero pochi progressi nello sviluppo di terapie più razionali o mirate”, afferma. Questo vale in generale per i tumori solidi infantili. Sebbene questi tumori siano meno comuni dei tumori del sangue nei bambini, rappresentano oltre la metà dei decessi per cancro nei bambini di età compresa tra 0 e 14 anni negli Stati Uniti. Questi tumori infantili differiscono da quelli degli adulti nella loro biologia e quindi richiedono trattamenti distinti. Eppure, degli oltre 180 farmaci antitumorali approvati dalla Food and Drug Administration (FDA) statunitense dal 2000, meno di una dozzina sono stati sviluppati specificamente per i bambini.

Le proteine oscure nascoste nelle nostre cellule potrebbero contenere indizi sul cancro e altre malattie
Mossé ora ripone le sue speranze in molecole prodotte in laboratorio che dirottano il meccanismo di eliminazione delle proteine nelle cellule. I farmaci tipici inceppano l’estremità attiva di una proteina per inibirne l’attività. Le PROTAC, abbreviazione di chimere mirate alla proteolisi, eliminano completamente la proteina. Lo fanno legando le proteine associate a malattie nelle cellule umane a un enzima che le marca per la distruzione.
Rendere possibili questi incontri fatali – che il biochimico Alessio Ciulli dell’Università di Dundee, nel Regno Unito, definisce un “bacio della morte” proteico – amplia l’elenco dei possibili bersagli farmacologici. Delle circa 3.000 proteine note per causare cancro e altre malattie, i farmaci approvati dalla FDA, ad esempio, ne colpiscono meno di 700. La maggior parte delle restanti è considerata “non trattabile”, perché non esiste una sede adatta in cui un farmaco possa attaccarsi e bloccare l’attività della proteina. Ma un PROTAC deve solo aggrapparsi; il meccanismo cellulare esistente fa il resto.
Almeno 30 PROTAC sono entrati nella sperimentazione clinica dal 2019, quando sono iniziati i test sull’uomo, principalmente per il cancro, ma anche per il morbo di Parkinson, i disturbi infiammatori e il dolore. I tre più avanzati, per il cancro al seno, il cancro alla prostata e la leucemia, sono in fase III, l’ultima fase prima dell’autorizzazione all’immissione in commercio. La maggior parte degrada proteine bersaglio di farmaci già approvati.

Evan Lindberg, nella foto a sinistra con il padre Gavin, è morto di cancro all’età di sette anni. Gavin è ora un sostenitore dei diritti dei pazienti e collabora con l’oncologa pediatrica Yael Mossé (a destra) e altri per sviluppare trattamenti per i tumori infantili. Crediti: Wendy Lindberg, Children’s Hospital di Philadelphia
Mossé e i suoi colleghi stanno facendo qualcosa di diverso e più rischioso, puntando su proteine tumorali mai trattate prima. Mossé è co-Direttore di un team che sta sviluppando PROTAC contro proteine non trattabili, responsabili del neuroblastoma e di altri tumori infantili, inclusi quelli del cervello, del fegato e delle ossa. Tutti questi tumori danno origine a tumori solidi. Mossé prevede che i primi PROTAC del team entreranno nella fase di sperimentazione clinica nei prossimi due anni.
Altri ricercatori mirano in modo simile a degradare proteine a lungo considerate intoccabili, nel cancro e non solo. “Dimostrare che è possibile raggiungere un obiettivo completamente nuovo con questa tecnologia sarà un momento cruciale per il settore“, afferma il chimico Nathanael Gray della Stanford University in California, co-fondatore di C4 Therapeutics, un’azienda farmaceutica specializzata nella degradazione proteica con sede a Watertown, Massachusetts.
Più di un trucco da laboratorio
Il primo PROTAC funzionante fu dimostrato nel 2001, quando Craig Crews, biologo chimico presso la Yale University di New Haven, Connecticut, il biochimico Raymond Deshaies, del California Institute of Technology di Pasadena, e i loro colleghi ne costruirono uno che degradava la sua proteina bersaglio nel fluido cellulare ricavato dalle uova di rana. All’epoca, la maggior parte degli scienziati considerava i PROTAC un trucchetto di laboratorio. Quando Ciulli iniziò a lavorarci nel 2009, i colleghi “alzarono gli occhi al cielo”, ricorda. “Dissero: ‘PROTAC? Non saranno mai farmaci'”.
Un primo ostacolo è stato rendere i PROTAC sufficientemente piccoli da penetrare nelle cellule. Un altro è stato progettarli in modo che si aggrappassero agli enzimi più abbondanti ed efficienti, noti come ubiquitina ligasi. Questi enzimi, di cui esistono circa 600 tipi, etichettano le proteine per la distruzione attaccando catene di proteine molto più piccole chiamate ubiquitine (vedi “Proteine eliminate”). Dopo un grande sforzo, tre articoli nel 2015 hanno rivelato potenti PROTAC che eliminavano quasi completamente le proteine bersaglio nelle cellule e nei topi. “Dopo quegli articoli, non c’erano dubbi sul fattto che potessimo degradare le proteine”, afferma Ciulli. “Ora si apriva un intero mondo di bersagli”. Coautore di uno degli articoli, Ciulli ha poi contribuito a fondare Amphista Therapeutics, un’azienda di degradazione proteica a Cambridge, nel Regno Unito.
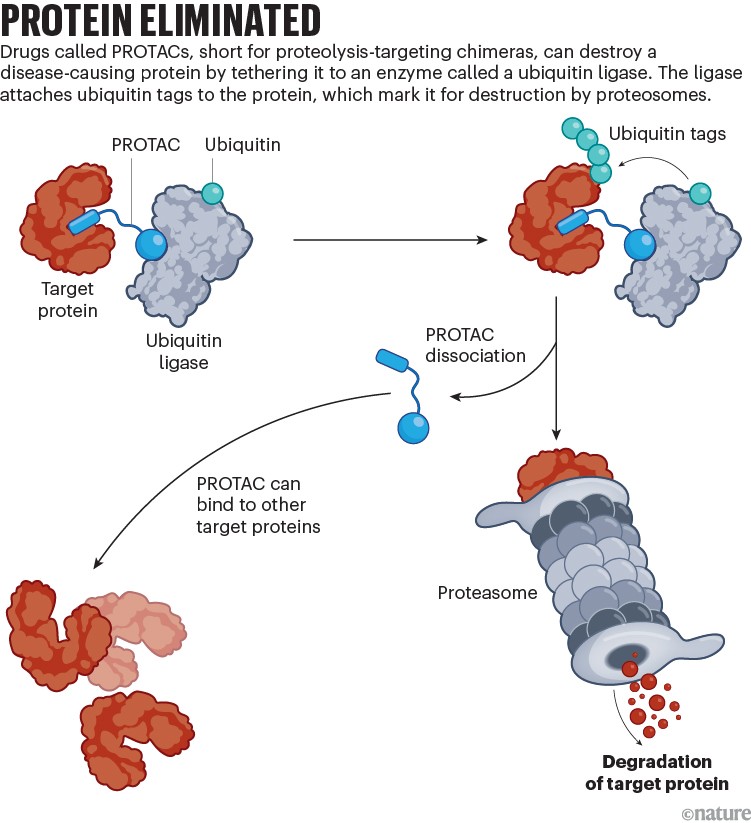
Gli articoli hanno evidenziato un vantaggio chiave dei PROTAC. Mentre i farmaci convenzionali devono insediarsi su una proteina patogena, i PROTAC interagiscono brevemente con il loro bersaglio, lo inviano alla distruzione e passano al bersaglio successivo. Questa caratteristica “cattura e rilascia” significa che dosi molto piccole possono essere utilizzate a lungo. Un altro vantaggio è che i PROTAC non fanno prigionieri. Alcune proteine contribuiscono a una malattia in più modi, ma eliminando completamente la proteina, un PROTAC elimina tutti i possibili contributi.
Gli articoli del 2015 hanno definito i PROTAC come la prossima ondata di farmaci. “Non ho mai visto una tecnologia essere adottata così ampiamente e così rapidamente”, afferma Gray.
Questa scienziata ha curato il suo cancro con virus coltivati in laboratorio
Tutto questo accadde troppo tardi per Evan Lindberg. Nel 2010, suo padre lo iscrisse a uno degli studi clinici di Mossé, per testare un farmaco esistente contro una proteina spesso alterata nel neuroblastoma. Il cancro di Evan non rispose. Il tumore conteneva anche copie extra del gene di una proteina notoriamente responsabile dei tumori infantili, il fattore di trascrizione MYCN. MYCN attiva i geni che stimolano la replicazione cellulare durante lo sviluppo infantile. Una quantità eccessiva può trasformare tumori altrimenti curabili in letali e aggressivi attraverso una crescita incontrollata. Ma fattori di trascrizione come MYCN sono considerati non trattabili farmacologicamente.
Durante un convegno su MYCN nel 2019, Mossé si rese conto che i PROTAC potevano essere una soluzione. Uno dei fondatori dell’azienda produttrice di PROTAC, Nurix Therapeutics di San Francisco, in California, partecipò all’incontro e “ci spinse davvero a pensare alla degradazione proteica mirata e a concentrarci su MYCN, per cercare di fare davvero qualcosa di grande”, afferma Mossé. Grazie a un finanziamento di una fondazione privata, iniziò a collaborare con Nurix. Il lavoro si espanse nel 2024, quando un team che Mossé riunì insieme al biochimico Martin Eilers dell’Università di Würzburg in Germania vinse un ingente finanziamento da Cancer Grand Challenges, un’iniziativa globale no-profit che si occupa di combattere i tumori solidi infantili.
Il team, denominato KOODAC, acronimo di “Knocking Out Oncogenic Drivers and Curing Childhood Cancers”, comprende anche scienziati provenienti da Regno Unito, Austria e Francia e rappresentanti dei pazienti in cinque continenti. Tra questi, Gavin Lindberg e sua moglie Wendy che, dopo la morte di Evan, hanno istituito una fondazione benefica che negli ultimi dieci anni ha finanziato una posizione di ricerca nel laboratorio di Mossé. Il team si sta concentrando su MYCN e altri quattro target proteici. L’obiettivo è trovare farmaci che non solo funzionino, ma che siano anche più pratici delle infusioni ospedaliere e sufficientemente economici da poter essere acquistati nei Paesi a basso e medio reddito, dove le famiglie spesso devono rinunciare o abbandonare le cure a causa dei costi.
Uccidere gli assassini dell’infanzia
Tre delle proteine su cui si sta concentrando il team KOODAC derivano da un tipo di errore genetico spesso presente nei tumori. L’incrocio, la rottura e la riparazione dei cromosomi possono dare origine a un nuovo gene ibrido – una fusione genica – che presenta sequenze di entrambi i geni originali. Le proteine di fusione risultanti sono la causa diretta di molte leucemie, linfomi e tumori solidi infantili. Due di queste proteine di fusione sono responsabili del sarcoma di Ewing e del rabdomiosarcoma, tumori infantili devastanti delle ossa e dei tessuti molli. La terza causa un raro tumore al fegato.
“Man mano che le cellule tumorali si evolvono, le proteine di fusione persistono, rendendole bersagli interessanti”, afferma Charles Mullighan, ematologo presso il St. Jude Children’s Research Hospital di Memphis, nel Tennessee. Mullighan e i suoi colleghi producono e testano PROTAC e degradatori proteici simili per i tumori del sangue infantili e i tumori cerebrali. “Quanto alla possibilità che i degradatori proteici possano curare questi tumori, “c’è il potenziale” “, afferma Mullighan. Ma aggiunge che un solo farmaco potrebbe non essere sufficiente. “I tumori sono subdoli e possono trovare il modo di aggirarli”.
Oltre a KOODAC, altri due team del Cancer Grand Challenges si stanno occupando di tumori solidi infantili. Un team riunisce ricercatori provenienti da nove istituti in Europa e negli Stati Uniti per lavorare su degradatori proteici e terapie cellulari. L’altro, che include ricercatori di otto istituti negli Stati Uniti, nel Regno Unito e in Francia, si concentra esclusivamente sulle terapie cellulari. Queste ampie collaborazioni accademiche sono essenziali per progredire nella lotta ai tumori infantili, affermano i ricercatori. “Per i tumori pediatrici, il mercato è così piccolo che non rientra nel piano di commercializzazione di un’azienda farmaceutica tradizionale”, afferma Catherine Bollard, co-responsabile del team di terapia cellulare ed ematologa pediatrica presso il Children’s National Hospital di Washington DC.
Leggi anche:Cancro: trucco cellulare rende i farmaci 23 volte più potenti
L’universo PROTACtable
Nessun PROTAC è stato ancora approvato. Il primo ad entrare nella fase III di sperimentazione, il Vepdegestrant, sviluppato da Arvinas a New Haven, Connecticut, degrada il recettore degli estrogeni su cui la maggior parte dei tumori al seno fa affidamento per la crescita. All’inizio di marzo, Arvinas e il suo partner, Pfizer, hanno riferito che il degradatore era più efficace di un farmaco antiestrogenico standard nel consentire alle partecipanti alla sperimentazione, i cui tumori presentavano una mutazione comunemente associata al cancro al seno, di vivere più a lungo senza peggioramento della malattia (sebbene non abbia ottenuto risultati migliori in un’analisi che ha incluso tutte le partecipanti alla sperimentazione). “Abbiamo in programma di condividere i dati della sperimentazione con le autorità di regolamentazione globali per supportare potenzialmente le richieste di autorizzazione”, ha scritto il responsabile medico di Arvinas, Noah Berkowitz, in un’e-mail a Nature. Sono in corso altri due studi di fase III sul Vepdegestrant.
Nel frattempo, altri due PROTAC hanno raggiunto la fase III di sperimentazione. Uno degrada il recettore degli androgeni che causa la maggior parte dei tumori prostatici metastatici; l’altro, l’enzima BTK richiesto dalle leucemie linfatiche croniche. Farmaci contro questi bersagli sono già disponibili, ma i tumori in stadio avanzato diventano inevitabilmente resistenti.
Fonte: Nature