(Cancro del pancreas-Immagine Credit Public Domain).
Le mutazioni associate al cancro promuovono la formazione di tumori pancreatici dopo una lesione tissutale, ma non è chiaro come ciò avvenga. Le modifiche alla cromatina nelle cellule danneggiate con tali mutazioni spiegano questa predisposizione alla malignità.
È sempre più chiaro che, man mano che gli esseri umani invecchiano, molti, se non la maggior parte, dei nostri tessuti diventano composti da popolazioni di cellule, chiamate cloni, che spesso ospitano mutazioni genetiche trovate nei tumori maligni che derivano dallo stesso tipo di tessuto. Sebbene queste popolazioni clonali sembrino essere normali lignaggi cellulari a parte le mutazioni associate al cancro, si sa poco su come queste cellule rispondano ai danni causati dall’esposizione alla luce ultravioletta o alle sostanze chimiche tossiche, per esempio. Un processo chiamato metaplasia, ovvero la sostituzione di un tipo di cellula con un altro dopo un danno tissutale, aumenta il rischio di formazione del cancro. Perché la riparazione anormale durante la metaplasia predispone le cellule a formare il cancro è principalmente sconosciuto. In un articolo pubblicato in Nature, Alonso-Curbelo et al. riportano uno studio sul cancro del pancreas nei topi che rivela come una mutazione distorca l’esito della metaplasia verso lo sviluppo del cancro.
La maggior parte dei tumori pancreatici umani contiene mutazioni nel gene KRAS, che codifica per un tipo di enzima, chiamato GTPasi, che ha un ruolo chiave nella segnalazione. L’enzima KRAS contribuisce al controllo della crescita cellulare nei tessuti sani, ma le mutazioni che promuovono il cancro causano l’iperattivazione dell’enzima che porta alla continua crescita cellulare. Le cellule epiteliali nei dotti pancreatici possono, guidate da mutazioni KRAS che promuovono il cancro, diventare un tipo di tumore maligno chiamato adenocarcinoma duttale pancreatico (PDAC).
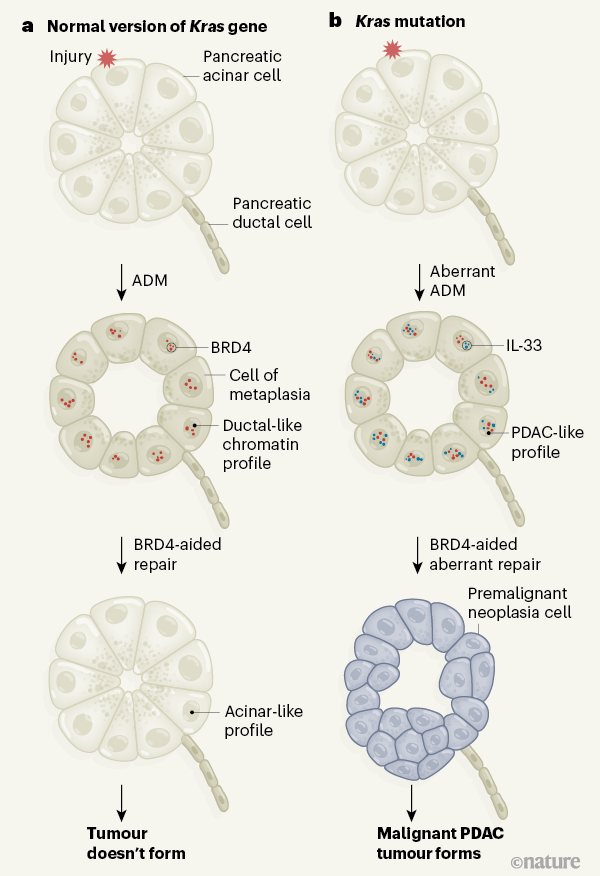
In generale, le mutazioni KRAS da sole non sono sufficienti per guidare lo sviluppo del tumore; tuttavia, possono agire di concerto con il danno tissutale mediato dall’ambiente per accelerare la trasformazione maligna del cancro del pancreas. Ciò si verifica per la regolazione aberrante della metaplasia (Fig. 1), in cui un tipo di cellula epiteliale pancreatica (una cellula acinosa) viene temporaneamente riprogrammata in un altro tipo (una cellula simile a una cellula duttale). Questa transizione è chiamata metaplasia da acino a duttale (ADM) e tale conversione dello stato delle cellule epiteliali si verifica in risposta allo stress ambientale.
Figura 1 | In che modo una mutazione di Kras aiuta la formazione di tumori dopo un infortunio. a , Se le cellule pancreatiche (in questo caso, le cellule con una versione normale del gene Kras ) vengono danneggiate, si verifica un processo chiamato metaplasia acinosa-duttale (ADM), che genera una crescita nota come metaplasia. Le cellule acinose assumono transitoriamente le caratteristiche delle cellule duttali e la loro cromatina (il complesso di DNA e proteine nucleari) viene riconfigurata per ottenere un profilo simile a quello delle cellule duttali. La proteina BRD4 aiuta a ristabilire un profilo della cromatina simile ad un acino una volta che lo stress che causa danni è terminato. Ciò contribuisce alla “riparazione” della metaplasia e limita la crescita cellulare. b , Alonso-Curbelo et al. riferiscono che, se le cellule pancreatiche di topo che hanno una mutazione di Kras sono danneggiate, l’ADM aberrante fa sì che le cellule acquisiscano un profilo della cromatina simile a quello di un tumore maligno chiamato adenocarcinoma duttale pancreatico (PDAC). BRD4 può accedere a regioni “aperte” di questa cromatina per promuovere la formazione di una crescita premaligna e disregolata chiamata neoplasia (in particolare, una neoplasia intraepiteliale pancreatica). La formazione di neoplasia è aiutata dalla proteina interleuchina-33 (IL-33), che è altamente espressa dopo la lesione se le cellule hanno una mutazione Kras . Una neoplasia può svilupparsi in PDAC.
Gli autori hanno cercato di capire perché le cellule pancreatiche di topo con mutazioni nel gene Kras rispondono in modo diverso all’insulto ambientale rispetto alle cellule prive di tali mutazioni. Le cellule coltivate in vitro non riproducono fedelmente gli eventi all’interno dei tessuti viventi, quindi Alonso-Curbelo et al. hanno utilizzato una sofisticata ingegneria genetica per sviluppare modelli murini. Questi animali hanno permesso agli autori di tracciare in modo specifico il destino delle cellule acinose e duttali pancreatiche che avevano versioni normali o mutanti di Kras e determinare la loro risposta al danno tissutale mediato dal trattamento chimico.
Coerentemente con il lavoro precedente, gli autori hanno scoperto che la rigenerazione delle cellule pancreatiche danneggiate dopo l’ADM mediata da lesioni tissutali era compromessa nei topi con una mutazione di Kras. A differenza dei topi normali, quelli con Kras mutante hanno sviluppato rapidamente un tipo di crescita cellulare precancerosa – descritta come neoplasia intraepiteliale pancreatica – che è un precursore della formazione di PDAC.
La rapida comparsa di questa neoplasia, in particolare nei topi mutanti Kras dopo la lesione dei tessuti, ha portato gli autori a ipotizzare che la regolazione aberrante della cromatina (il complesso del DNA e delle proteine istoniche nel nucleo) potrebbe spiegare come si sviluppa successivamente il PDAC. Per indagare su questo, Alonso-Curbelo e colleghi hanno esaminato le cellule che avevano Kras normale o mutante per valutare eventuali differenze a livello di genoma nell’accessibilità della cromatina. L’accessibilità qui si riferisce alle regioni genomiche che si trovano in una conformazione “aperta” che consente alle proteine del fattore di trascrizione che legano il DNA di accedere al DNA e regolare l’espressione dei geni vicini.
Dopo la lesione, le cellule con mutazioni di Kras hanno acquisito un profilo di accessibilità della cromatina che ricorda da vicino quello trovato nelle cellule PDAC. Al contrario, le regioni della cromatina recentemente accessibili identificate nelle cellule con mutazioni di Kras sono rimaste in una conformazione “chiusa” nelle cellule pancreatiche normali dopo la lesione. Questi dati, coerenti con i risultati pubblicati quest’anno, suggeriscono che la combinazione della mutazione di Kras e del danno tissutale causato da una lesione mediata dall’ambiente guida un primo passo nel percorso verso la formazione del tumore stabilendo un profilo di accessibilità della cromatina associato al cancro prima di una completa trasformazione maligna delle cellule.
Vedi anche:Identificato un biomarcatore per la diagnosi precoce del cancro del pancres
I siti di cromatina accessibile spesso contengono sequenze di DNA chiamate potenziatori che aiutano a regolare l’espressione genica. Alonso-Curbelo et al. hanno affermato che le proteine coinvolte nella regolazione trascrizionale potrebbero agire in regioni di maggiore accessibilità della cromatina nelle cellule con mutazioni di Kras e guidare l’ADM indotto dal danno del tessuto a passare alla neoplasia intraepiteliale pancreatica. Per indagare su questa possibilità, gli autori hanno utilizzato una tecnica chiamata interferenza dell’RNA per diminuire la produzione di BRD4, una proteina co-attivatrice trascrizionale necessaria per l’espressione di molti geni, in particolare quelli la cui espressione è diretta da gruppi di elementi enhancer chiamati super- esaltatori. Ciò ha rivelato che BRD4 è necessario sia per la riparazione dei tessuti nelle cellule normali a seguito di ADM indotta da lesioni, sia per l’ADM per portare a neoplasia intraepiteliale pancreatica nel contesto di una mutazione di Kras .
Nell’analisi dei geni potenzialmente responsabili dello sviluppo della neoplasia intraepiteliale pancreatica, gli autori si sono concentrati sul gene Il33, la cui espressione è aumentata rapidamente sulle lesioni nelle cellule con mutante Kras . Il33 codifica per la proteina interleuchina-33, un tipo di molecola di segnalazione del sistema immunitario infiammatorio chiamata citochina. Alonso-Curbelo et al . hanno scoperto che le cellule pancreatiche danneggiate con mutazioni di Kras avevano una maggiore accessibilità della cromatina nella regione che codifica per Il33 e una maggiore espressione di Il33 rispetto alla situazione nelle cellule ferite con Kras normale. Fondamentale, questo aumento di Il33 richiedeva la normale espressione di BRD4.
Per confermare l’importanza dell’interleuchina-33, gli autori hanno somministrato questa proteina ai loro topi modello di lesione tissutale. Il trattamento ha accelerato lo sviluppo della neoplasia intraepiteliale pancreatica se gli animali avevano una mutazione Kras , ma non ha avuto effetto se gli animali avevano Kras normale . Sebbene i componenti precisi del meccanismo trascrizionale necessario per l’ espressione di Il33 in un contesto Kras- mutante rimangano da stabilire, gli autori dimostrano chiaramente che BRD4 ha un ruolo.
Questi dati sono coerenti con l’osservazione che i farmaci di prima generazione che prendono di mira in modo non selettivo i moduli di regolazione genica chiamati BET bromodomini (BD1 e BD2), che sono presenti in tutte le proteine BET, incluso BRD4, hanno dimostrato una certa utilità quando testati su animali modelli o in clinica contro un’ampia gamma di tumori, compreso il PDAC. Gli inibitori BET di nuova generazione possono alterare preferenzialmente sia il mantenimento che l’induzione dell’espressione genica coinvolgendo, rispettivamente, BD1 o BD2 delle proteine BET. Dato che l’ induzione di Il33 è alla base della transizione verso la formazione di PDAC nelle cellule con un Kras mutazione, sarebbe interessante verificare se un inibitore selettivo BD2 potrebbe prevenire o ridurre la transizione alla formazione del tumore.
Negli esseri umani, il danno pancreatico causato da insulti ambientali come un’elevata assunzione di alcol può provocare una condizione infiammatoria chiamata pancreatite cronica, che aumenta notevolmente il rischio di sviluppare PDAC. Tuttavia, i meccanismi che potrebbero spiegare questa osservazione sono rimasti elusivi. Questo studio di Alonso-Curbelo et al . evidenzia come la presenza di mutazioni associate al cancro in quelle che sembrano essere cellule essenzialmente normali possa determinare una notevole alterazione nel modo in cui rispondono alla lesione, spingendole così verso la formazione del tumore favorendo la formazione di una neoplasia.
Dato che molti dei nostri tessuti, comprese le cellule epiteliali del sangue, della pelle e dell’intestino, hanno popolazioni cellulari clonali che sono spesso soggette a danni mediati dall’ambiente, le scoperte di Alonso-Curbelo e colleghi potrebbero avere implicazioni di vasta portata. I loro risultati dovrebbero costituire la base di studi futuri su come i cloni precancerosi in altri contesti tissutali rispondono alle lesioni. Tali intuizioni potrebbero, a loro volta, portare al target farmacologico dei fattori che guidano le anomalie nella rigenerazione dei tessuti dopo l’inizio della metaplasia.
Fonte:Nature