Quasi 50 anni dopo la prima proposta del concetto, la terapia genica è ora considerata un’opzione terapeutica promettente per diverse malattie umane. Il percorso verso il successo è stato lungo e tortuoso. Negli studi clinici iniziali sono stati riscontrati gravi effetti avversi, ma questo ha alimentato la ricerca di base che ha portato a vettori di trasferimento genico più sicuri ed efficienti. La terapia genica in varie forme ha prodotto benefici clinici in pazienti con cecità, malattia neuromuscolare, emofilia, immunodeficienze e cancro. Rivedere il lavoro pioneristico che ha portato il campo della terapia genica al suo stato attuale, descrivere le tecnologie di modifica genica che dovrebbero svolgere un ruolo importante nel futuro e discutere le sfide pratiche per portare queste terapie ai pazienti che ne hanno bisogno, è l’obiettivo di questa revisione.
( Vedi anche:La terapia genica mostra la promessa per invertire la cecità).
SFONDO
Quasi cinquant’anni fa, scienziati “visionari” ipotizzarono che la modificazione genetica del DNA esogeno potesse essere un trattamento efficace per le malattie ereditarie umane. Questa strategia di “terapia genica” offriva il vantaggio teorico che un beneficio clinico duraturo e possibilmente curativo sarebbe stato raggiunto con un singolo trattamento. Sebbene il viaggio dal concetto all’applicazione clinica sia stato lungo e tortuoso, la terapia genica ora sta introducendo nuove opzioni terapeutiche in molteplici campi della medicina. Esaminiamo le scoperte critiche che portano allo sviluppo di terapie geniche di successo, concentrandoci sulla somministrazione diretta in vivo di vettori virali, sul trasferimento adottivo di cellule T geneticamente modificate o su cellule staminali ematopoietiche e su tecnologie emergenti di modifica del genoma.
ANTICIPI
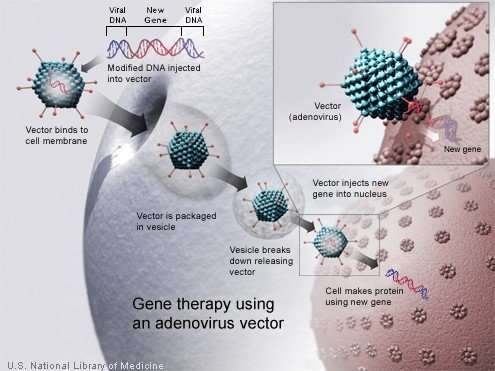
Lo sviluppo di vettori di geni come i virus retroattivi replicabili e il virus adeno-associato (AAV), insieme a risultati incoraggianti nei modelli di malattia preclinica, ha portato all’inizio di studi clinici nei primi anni ’90. Sfortunatamente, queste prime sperimentazioni hanno evidenziato gravi tossicità correlate alla terapia, comprese risposte infiammatorie ai vettori e tumori maligni causate dall’attivazione inserzionale mediata da vettori di proto-oncogeni. Queste battute d’arresto hanno alimentato più ricerche di base in virologia, immunologia, biologia cellulare, sviluppo di modelli e malattie bersaglio, che alla fine hanno portato alla traduzione clinica di successo delle terapie genetiche negli anni 2000.
I vettori lentivirali migliorano l’efficienza del trasferimento genico alle cellule. Nelle prove cliniche della fase iniziale, questi vettori più sicuri e più efficienti sono stati utilizzati per la trasduzione di cellule staminali ematopoietiche autologhe, portando a beneficio clinico in pazienti con immunodeficienze, emoglobinopatie e disturbi metabolici e di conservazione. Le cellule T ingegnerizzate per esprimere recettori chimerici specifici dell’antigene CD19 hanno dimostrato di avere una potente attività antitumorale in pazienti con tumori maligni linfoidi. La somministrazione in vivo di vettori di AAV terapeutici alla retina, al fegato e al sistema nervoso ha portato a miglioramenti clinici rispettivamente nei pazienti con cecità congenita, emofilia B e atrofia muscolare spinale. Negli Stati Uniti, le approvazioni della FDA (Food and Drug Administration) dei primi prodotti di terapia genica si sono verificate nel 2017, incluse le cellule T (chimer antigen receptor) per trattare tumori maligni delle cellule B e vettori AAV per il trattamento in vivo della cecità congenita.
Negli ultimi anni sono state sviluppate tecnologie di modifica del genoma basate su nucleasi ingegnerizzate o batteriche. In contrasto con i vettori virali, che possono mediare solo l’aggiunta del gene, gli approcci di modifica del genoma offrono un bisturi preciso per l’aggiunta del gene, l’ablazione genica e la correzione del gene. L’editing del genoma può essere eseguito su cellule ex vivo o il macchinario di editing può essere consegnato in vivo per effettuare il genoma editing in situ. La traduzione di queste tecnologie per la cura del paziente è nella sua infanzia rispetto alle terapie di aggiunta genica virale, ma si prevede che nel corso del prossimo decennio si apriranno numerosi studi clinici di modifica del genoma.
PROSPETTIVA
Basandosi su decenni di progressi scientifici, clinici e produttivi, le terapie geniche hanno iniziato a migliorare la vita dei pazienti con cancro e una varietà di malattie genetiche ereditarie. Saranno necessari partenariati con aziende biotecnologiche e farmaceutiche con esperienza nel settore manifatturiero e di scala, affinché queste terapie abbiano un ampio impatto sulla malattia umana. Rimangono molte sfide, compresa la comprensione e la prevenzione della genotossicità dall’integrazione di vettori o dalla modifica del genoma off-target, il miglioramento del trasferimento genico o l’efficienza di editing ai livelli necessari per il trattamento di molte malattie bersaglio, la prevenzione delle risposte immunitarie che limitano la somministrazione in vivo di vettori o complessi di editing del genoma, superando ostacoli manifatturieri e normativi. È importante sottolineare che, è necessario raggiungere un consenso sociale sull’etica dell’aggiornamento genomico germinale alla luce dei rapidi progressi scientifici che hanno reso questo problema reale piuttosto che ipotetico. La capacità delle terapie genetiche di fornire benefici duraturi alla salute umana, esemplificata dai progressi scientifici e dai successi clinici degli ultimi anni, giustifica il costante ottimismo e gli sforzi crescenti verso la realizzazione di queste terapie come parte del nostro trattamento standard per le malattie umane. I sostennitori e i medici e le aziende dovranno collaborare per progettare e testare nuovi modelli per facilitare la consegna di terapie costose, ma potenzialmente curative e renderle accessibili a tutti i pazienti.
Fonte: Science