Ricerca epigenetica-Immagine:meccanismi epigenetici influenzano il modo in cui il DNA viene confezionato nei cromosomi e quindi quanto sono accessibili i geni per la trascrizione. Credito: Ella Maru Studios.
Le analisi epigenomiche suggeriscono nuovi approcci promettenti per il monitoraggio e il trattamento del cancro. Che cosa stanno scoprendo le analisi e quanto sono vicine al miglioramento dei risultati per i pazienti?
Quando si tratta di cancro, i meccanismi che influenzano l’espressione dei geni senza modificarne la sequenza codificante sono importanti quanto le mutazioni genetiche. Tuttavia, la ricerca su questi processi epigenetici è rallentata perché in passato erano difficili da studiare. “Le nuove tecnologie ci permettono di raggiungere le conoscenze genetiche”, afferma Céline Vallot, che si occupa di epigenetica del cancro presso l’Institut Curie di Parigi.
I processi epigenetici funzionano tipicamente modificando la struttura della cromatina: il DNA e le proteine istoniche che compongono i cromosomi. Se la cromatina è aperta e accessibile, può avvenire la trascrizione genica; dove è più compatta i geni vengono silenziati. La conformazione della cromatina può essere alterata da enzimi che marcano chimicamente il DNA o gli istoni attorno a cui si avvolge. La maggior parte della ricerca epigenetica si è concentrata sui processi che influenzano questi enzimi e su come questi potrebbero attivare gli oncogeni o disattivare i geni soppressori del tumore.
La struttura della cromatina e quindi l’espressione genica, è influenzata anche dal DNA non codificante, che costituisce il 98% del genoma. In particolare, ci sono regioni corte che governano l’espressione dei geni vicini e l’attenzione si sta rivolgendo alle mutazioni che colpiscono questi cosiddetti potenziatori e isolanti. “Le alterazioni epigenetiche che modificano i confini tra le vicinanze dei geni causano una stimolazione inappropriata dei geni“, afferma Howard Chang, Direttore del Center for Personal Dynamic Regulomes presso l’Università di Stanford, in California. Il gruppo di Chang sta sperimentando metodi per studiare l’epigenoma e identificare i meccanismi chiave che regolano la trascrizione nei campi del cancro, dello sviluppo e dell’invecchiamento.
I profili trascrizionali aberranti che risultano da alterazioni epigenetiche possono essere utilizzati non solo per distinguere diversi sottotipi di cancro, ma anche come modo per rilevare tumori da campioni di sangue. I farmaci che prendono di mira i regolatori epigenetici sono già approvati per il trattamento della sindrome mielodisplastica, dei linfomi a cellule T e del mieloma multiplo.
Tuttavia, le terapie epigenetiche devono ancora realizzare il loro pieno potenziale. Le attuali terapie sono limitate dalla tossicità e dagli effetti fuori bersaglio. I progressi nelle tecnologie di sequenziamento di prossima generazione stanno consentendo ai ricercatori di mappare le informazioni epigenomiche e i loro effetti sulla struttura della cromatina in modo più dettagliato che mai. Studiando il panorama epigenetico delle cellule tumorali e delle cellule immunitarie con cui combattono, i ricercatori stanno identificando nuovi bersagli epigenetici e approcci terapeutici. Questa conoscenza sta aiutando sia a migliorare la selettività delle terapie epigenetiche sia ad adattare i trattamenti alle caratteristiche di ciascun paziente.
Epigenetica e immuno-oncologia
L’oncologa pediatrica Crystal Mackall e il suo team dell’Università di Stanford stanno utilizzando ATAC-seq (Assay for Transposase-Accessible Chromatin using sequencing ) per rivelare i meccanismi epigenetici che regolano l’esaurimento delle cellule T, uno stato di disfunzione progressiva che si sviluppa quando le cellule vengono continuamente stimolate dagli antigeni e fattori infiammatori. Superare l’esaurimento delle cellule T è fondamentale se si vuole migliorare la durata delle terapie con cellule T con recettori dell’antigene chimerico (CAR).
“ATAC-seq fornisce una visualizzazione senza precedenti delle regioni più attive dal punto di vista trascrizionale del genoma”, afferma. Il team di Mackall ha utilizzato ATAC-seq per identificare i fattori di trascrizione che vengono sovraregolati durante l’esaurimento delle cellule T CAR.
Lo scopo del team dell’Università di Stanford è quello di interrompere i programmi trascrizionali che guidano l’espressione genetica associata all’esaurimento. I ricercatori hanno trovato un percorso probabile: la sovraespressione del fattore di trascrizione c-Jun sembra prevenire l’esaurimento e migliorare il controllo del tumore, aprendo la strada alle terapie CAR-T di prossima generazione a prova di esaurimento.
Combinando la conoscenza epigenetica con le tecnologie di editing genetico come CRISPR, Mackall prevede di vedere più “ingegneria epigenetica”, che prenderà di mira le regioni regolatrici non codificanti del genoma. “Invece di rimuovere completamente l’espressione dei geni associati all’esaurimento, attraverso l’ingegneria epigenetica possiamo perfezionare la loro espressione e impedire alle cellule di reagire in un certo modo in un contesto particolare”, spiega. “Abbiamo visto che funziona, dobbiamo ancora scoprire se è utile”.
Vallot concorda sul fatto che siano necessari ulteriori miglioramenti nelle tecnologie epigenetiche prima che i risultati attuali vengano tradotti nei pazienti. “La tecnologia sta iniziando ad essere applicata ai campioni dei pazienti”, afferma. “Spero che, tra cinque anni, possa essere utilizzato per caratterizzare ampie coorti di pazienti per una terapia personalizzata”.
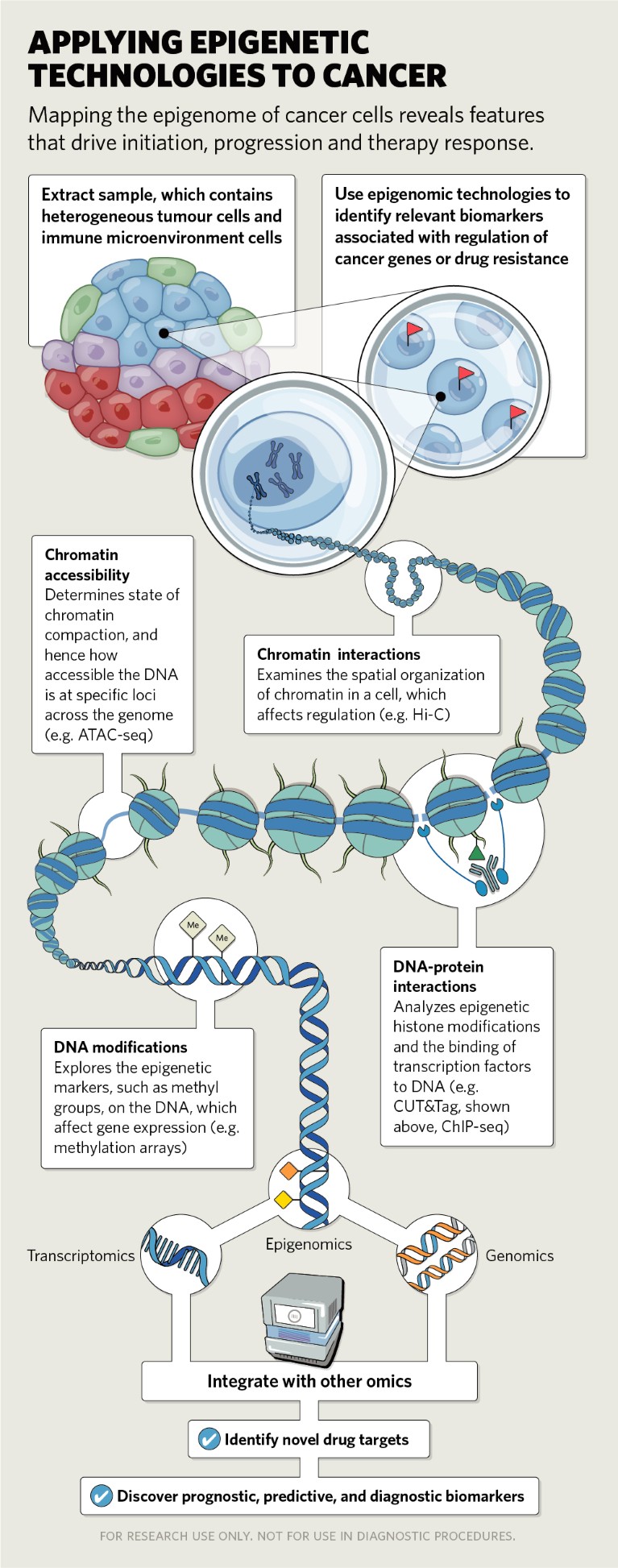
Tecnologie epigenetiche unicellulari emergenti
Fino a poco tempo fa, la maggior parte degli studi dipendeva da tecniche che misuravano gli stati epigenetici medi delle popolazioni cellulari e dei tessuti. Sebbene abbiano fornito informazioni preziose sui meccanismi generalizzati, non consentono l’esame degli eventi epigenetici che si verificano in popolazioni cellulari scarsamente caratterizzate e in tipi cellulari rari all’interno di tessuti normali o tumorali.
Comprendere l’eterogeneità delle cellule tumorali, sia all’interno che tra i tumori, può far luce sulle caratteristiche che determinano il potenziale metastatico delle cellule e la sensibilità al trattamento. Sono stati descritti più di 30 metodi epigenomici unicellulari, che possono essere utilizzati per valutare la struttura della cromatina o l’accessibilità del DNA (come scATAC-seq), l’organizzazione tridimensionale dei cromosomi (scHI-c) e l’analisi dell’intero genoma, modifiche degli istoni e del DNA (scChIP-seq, scCUT&Tag).
L’epigenetista dello sviluppo Melanie Eckersley-Maslin ha utilizzato tecnologie monocellulari per studiare il rimodellamento epigenetico e il destino cellulare durante le prime fasi dello sviluppo embrionale. Ora è entrata a far parte del Peter MacCallum Cancer Center di Melbourne, in Australia, dove il suo team applicherà questi metodi per esaminare le traiettorie del destino delle cellule tumorali.
È risaputo che le cellule tumorali possono sviluppare modelli di espressione genetica che assomigliano a quelli osservati nelle cellule embrionali, ma i ricercatori sanno poco su come e perché ciò accade. “È come se le cellule avessero una crisi di mezza età“, afferma Eckersley-Maslin, “perdono la loro identità e diventano più simili a cellule embrionali, in grado di acquisire destini cellulari diversi e adattarsi a nuovi ambienti“. Gli scienziati sospettano che la comprensione del significato funzionale di questi cambiamenti abbia il potenziale per rivelare nuovi biomarcatori del cancro e bersagli farmacologici.
I ricercatori dell’Institut Curie hanno sviluppato un approccio che prevede l’immunoprecipitazione della cromatina di singole cellule seguita dal sequenziamento (scChIP-seq) per esplorare la plasticità delle cellule del cancro al seno e le sue implicazioni per il trattamento. Utilizzando modelli di cancro al seno derivati da pazienti, i ricercatori hanno trovato un sottoinsieme di cellule sensibili ai farmaci non trattate che condividono una firma cromatinica comune con le cellule resistenti al Tamoxifene. Il loro lavoro evidenzia la perdita di un particolare segno di cromatina, che è associato alla repressione trascrizionale stabile (H3K27me3) come meccanismo chiave alla base della resistenza ai farmaci.
“Gli approcci a singola cellula stanno aprendo la strada alla valutazione dell’eterogeneità epigenetica all’interno dei tumori, che è fondamentale per comprendere la plasticità delle cellule tumorali e il processo di evoluzione verso la resistenza“, afferma Vallot, l’autore principale dello studio. Vallot si sta concentrando su come le cellule cambiano la loro predisposizione epigenetica a diventare resistenti al trattamento nel tempo e se la chemioterapia può essere combinata con modulatori epigenetici per prevenire la chemioresistenza. “Il tempismo è cruciale”, afferma. “I modulatori epigenetici devono essere forniti all’inizio della chemioterapia per limitare la plasticità delle cellule tumorali e fermare l’evoluzione della resistenza”.
Un metodo alternativo per studiare la localizzazione genomica delle modificazioni istoniche e dei fattori di trascrizione è la tecnologia Cleavage Under Targets and Tagmentation (CUT&Tag). Il materiale di partenza per CUT&Tag sono cellule vive permeabilizzate o nuclei isolati, piuttosto che cellule o tessuti reticolati con formaldeide e tagliati, come nel caso del ChIP. Con CUT&Tag, la cromatina recuperata nella fase finale del protocollo si trova nelle vicinanze locali dei siti di legame della proteina di interesse. Le sequenze di DNA più corte isolate da CUT&Tag consentono una profondità di sequenziamento inferiore (3-5 milioni di letture).
“CUT&Tag è un modo efficace per profilare l’epigenoma delle singole cellule e identificare le prime fasi della malattia“, afferma il genetista specializzato in drosophila Kami Ahmad, che ha sviluppato la tecnologia con Steven Henikoff presso il Fred Hutchinson Cancer Research Center di Seattle, negli Stati Uniti. Il suo team sta applicando CUT&Tag ad alto rendimento per studiare sia la biologia del cancro negli esseri umani che i processi di sviluppo nei moscerini della frutta. Il loro ultimo lavoro esplora il profilo epigenetico delle singole cellule in campioni di pazienti affetti da leucemia acuta a fenotipo misto. L’eterogeneità della cromatina tra le cellule dello stesso paziente potrebbe avere importanti implicazioni per il trattamento. “Sembra che le cellule possano interconvertirsi tra due stati epigenetici e che i trattamenti possano favorire il cambiamento epigenetico”, spiega.
Mettere tutto insieme
La combinazione di tecniche epigenomiche per profilare più segni epigenetici all’interno della stessa singola cellula e la loro integrazione con informazioni trascrizionali e genetiche sarà fondamentale per generare profili cellulari completi e terapie antitumorali personalizzate. “Combinando diverse tecnologie i ricercatori stanno facendo cose davvero fantasiose e stanno ottenendo una migliore comprensione di ciò che accade nel cancro“, afferma Eckersley-Maslin.
Molti approcci multi-omici sono in fase di sviluppo per far avanzare la ricerca sul cancro. Includono tecnologie come ATAC-seq indicizzato trascritto (T-ATAC-seq) che combina il sequenziamento dei geni che codificano il recettore delle cellule T (TCR) con ATAC-seq per fornire informazioni sulla specificità del TCR e sullo stato epigenomico delle singole cellule T ; Perturb-ATAC, che combina le perturbazioni CRISPR con ATAC-seq per studiare le relazioni tra fattori che controllano gli stati della cromatina o espressione simultanea di ATAC e RNA ad alto rendimento con sequenziamento (SHARE-seq), un approccio altamente scalabile per misurare l’accessibilità della cromatina e l’espressione genica nella stessa singola cellula.
Leggi anche:Epigenetica: perché stiamo modificando geneticamente gli esseri umani? (video)
“Il futuro è luminoso per la tecnologia di sequenziamento avanzata nella ricerca sul cancro”, afferma Chang.
“La multiomica e i metodi di genomica spaziale sono due importanti progressi che ci stanno aiutando a imparare a leggere e riscrivere il genoma del cancro”.
Fonte: Nature

