La struttura delle proteine che proteggono i telomeri (proteine ” protective shield” da “scudo protettivo”) sono obiettivi promettenti per combattere il cancro, ma finora non esiste una forma efficace per attaccarle. In assenza di farmaci che distruggono i telomeri, il cancro conserva una delle sue proprietà più terribili, che è la capacità delle sue cellule di dividersi perpetuamente. Due anni fa, un gruppo di ricerca guidato da Maria A. Blasco presso lo Spanish National Cancer Research Centre (CNIO) ha analizzato diversi composti che hanno causato lesioni a queste strutture cromosomiche protette e ora, in uno studio pubblicato in Nature Communications, i ricercatori dimostrano che questi farmaci ottengono questo effetto agendo su PI3K, una proteina chiave nel cancro e nell’invecchiamento. Questa è la prima volta che è stato descritto un collegamento funzionale tra questo percorso ed i telomeri.
( Vedi anche: Come i telomeri proteggono le cellule dalla senescenza).
Da anni il gruppo di ricerca sta studiando percorsi per attaccare la telomeresi come una forma di blocco della divisione cellulare delle cellule cancerose e causarne la morte. In uno studio pubblicato nel 2015, i ricercatori hanno descritto una nuova strategia per raggiungere questo obiettivo dopo che gli inibitori della telomerasi avevano fallito; la telomerasi è un enzima necessario per allungare i telomeri, ma la sua inibizione non ha effetti immediati sulla distruzione dei telomeri.
“L’idea era quella di cercare farmaci che erano in grado di ridurre i livelli di TRF1, una delle proteine essenziali di protezione dell’ integrità dei telomeri”, ha detto Blasco. “Abbiamo trovato diversi composti che, quando somministrati, hanno causato danni in queste strutture e ciò ha portato le cellule tumorali a non essere in grado di dividersi, ma non sapevamo quale fosse il loro obiettivo preciso”.
Rimozione della protezione dei telomeri
In questo studio, Blasco, insieme a Paula Martínez e Marinela Méndez-Pertuz (primi autori dell’ articolo), ha proposto l’ipotesi che la riduzione di TRF1 sia dovuta all’azione di PI3K, in quanto i composti sviluppati dal CNIO appartengono a inibitori di PI3K, precedentemente identificati. Questa molecola fa parte di un percorso chiave nell’invecchiamento descritto da Cynthia Kenyon grazie ai suoi studi con C. elegans. Allo stesso modo, PI3K è una delle proteine più mutate nel cancro.

Al momento della somministrazione di questi composti chimici, i ricercatori hanno osservato che i livelli di TRF1 erano stati ridotti e, inoltre, l’azione di PI3K era stata inibita, ma non sapevano se c’era una connessione. È qui che entra in gioco un altro componente del percorso PI3K chiamato AKT. In condizioni normali, una delle funzioni di PI3K è di modificare AKT, attivando la fosforilazione. Tuttavia, questa reazione non si verifica in presenza di inibitori di PI3K.
“Abbiamo poi verificato attraverso diversi esperimenti, che AKT ha modificato TRF1 per fosforilazione. Bloccando PI3K, queste reazioni di fosforilazione sono state bloccate e TRF1 ha perso stabilità, la sua emivita è stata abbreviata e si è legata meno al telomero che è stato lasciato senza protezione. Questo risultato potrebbe avere implicazioni nella gestione dei tumori che presentano mutazioni PI3K e che vengono trattati con inibitori di PI3K”, dice Blasco.
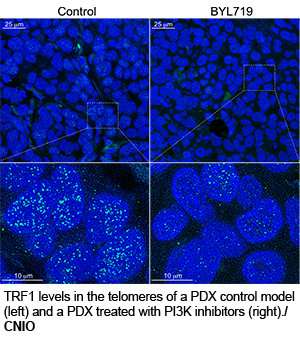
Nei topi Avatar o PDX, Blasco e collaboratori hanno determinato che la risposta al trattamento con inibitori di PI3K è correlata alla riduzione dei livelli di TRF1. Alla luce di questi risultati, sembra che l’attività antitumorale degli inibitori di PI3K dipenda dalla loro azione su TRF1. Pertanto, c’è ragione di credere che quei pazienti che sviluppano resistenza a questi farmaci possano beneficiare del trattamento con altri inibitori TRF1.
Fonte: Nature