Distrofia retinica-Immagine: Astratto grafico Credito: JCI Insight (2024).
Uno sforzo di squadra congiunto guidato dalla Dott.ssa Haruhisa Inoue (Professore, Dipartimento di crescita e differenziazione cellulare, CiRA) ha creato cellule iPS da due pazienti con distrofia retinica associata a EYS (EYS-RD) e le ha convertite in organoidi retinici per studiare la radice causa di questa debilitante disabilità visiva.
Lo studio è stato pubblicato su JCI Insight.
Le distrofie retiniche ereditarie (IRD) rappresentano un insieme di patologie oculari degenerative che colpiscono le cellule fotorecettrici della retina e che possono portare alla perdita irreversibile della vista. L’IRD è una delle principali cause di disabilità visiva e cecità, colpisce oltre 4,5 milioni di persone in tutto il mondo ed è nota per essere causata da mutazioni in oltre 250 geni.
Le mutazioni nel gene dell’omologo degli occhi chiusi (EYS) contribuiscono principalmente ai casi di IRD. Tuttavia, molti modelli animali utilizzati per la modellizzazione della malattia mancano o presentano una versione alterata del gene EYS nei loro genomi, rendendo quindi difficile modellare la malattia nei mammiferi.
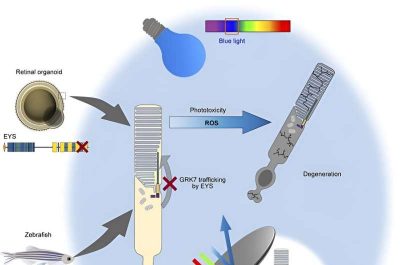
Attraverso studi sul pesce zebra, è stato descritto che l’EYS svolge un ruolo fondamentale nel mantenimento della struttura morfologica dei fotorecettori e nella regolazione del trasporto delle proteine verso i segmenti esterni delle cellule dei fotorecettori.
Tuttavia, non è chiaro se tali funzioni interrotte nei pazienti con IRD siano responsabili della malattia e se l’interruzione di tali processi biologici sia responsabile della patogenesi dell’IRD. Pertanto, è necessario creare nuovi modelli sperimentali utilizzando cellule umane per comprendere la malattia e ideare potenziali trattamenti.
A tal fine, il gruppo di ricerca ha derivato cellule iPS da due pazienti EYS-RD non imparentati con la stessa mutazione nel gene EYS e ha generato organoidi retinici da confrontarli con quelli ottenuti da cellule iPS sane per modellare la malattia.
L’analisi morfologica, istologica (immunofluorescenza e microscopia elettronica) e molecolare (sequenziamento di RNA a cellula singola) iniziale degli organoidi retinici EYS-RD suggerisce che la mutazione EYS non ha influenzato lo sviluppo retinico in modo tale che tutti i tipi di cellule erano presenti e tutti i compartimenti subcellulari erano presenti nelle cellule fotorecettrici formate correttamente.
Tuttavia, anche se la mutazione non ha influenzato la quantità totale di proteina EYS, il gruppo di ricerca ha notato meno proteine EYS, in particolare strutture punteggiate EYS-positive, nelle regioni delle ciglia o del segmento esterno (OS) delle cellule fotorecettrici negli organoidi retinici EYS-RD.
Al contrario, i ricercatori hanno esaminato la localizzazione subcellulare di PRPH2, un noto marcatore di OS, per scoprire che non era influenzato dalla mutazione EYS, suggerendo così che PRPH2 è trasportato nell’OS da un meccanismo indipendente da EYS.
Poiché EYS e GRK7, una proteina coinvolta nella terminazione e nel recupero della fotorisposta, sono entrambe proteine OS espresse prevalentemente nei coni (rispetto ai bastoncelli) e condividono una storia evolutiva simile (entrambe perse in alcune specie di mammiferi), le due proteine potrebbero essere funzionalmente collegate.
Leggi anche:Distrofia retinica: terapia genica approvata dalla FDA nel 2017 restituisce la vista a due bambini
Sorprendentemente, i ricercatori hanno osservato che GRK7 è significativamente ridotto, addirittura assente in alcuni casi, nella regione OS degli organoidi retinici mutanti. Al contrario, hanno scoperto che la mutazione EYS di interesse in questo studio non influenzava l’interazione proteina-proteina EYS-GRK7, indicando così che il difetto nella localizzazione subcellulare di GRK7 è causato principalmente da un’errata localizzazione di EYS piuttosto che da un’incapacità di interagire con GRK7 per il trasporto alla regione del sistema operativo.
Esprimendo una versione normale di EYS negli organoidi retinici EYS-RD, il gruppo di ricerca è riuscito a salvare questi difetti con il trasporto intracellulare GRK7.
Per convalidare ulteriormente questi risultati, il gruppo di ricerca ha eliminato il gene EYS da cellule iPS sane e da pesci zebra per generare rispettivamente organoidi retinici knockout (KO) derivati da cellule iPS umane e pesci zebra. Difetti simili nella localizzazione errata di GRK7 sono stati osservati in entrambi i sistemi sperimentali, confermando così il ruolo di EYS nel traffico di GRK7 e la perdita di funzione causata dalla mutazione EYS identificata nei pazienti.
Dato il ruolo di GRK7 nel terminare e mediare il recupero della fotorisposta, i ricercatori si sono poi concentrati sui cambiamenti indotti dalla luce nella retina del pesce zebra. Rispetto al pesce zebra eys-KO tenuto al buio, i mutanti eys-KO esposti alla luce LED bianca hanno mostrato una struttura retinica notevolmente interrotta, con una perdita diffusa di fotorecettori, che colpisce prevalentemente le popolazioni di cellule dei coni.
Un esame delle cellule sottoposte a un processo biologico chiamato morte cellulare programmata o apoptosi, ha costantemente mostrato un aumento dipendente dalla luce delle cellule morenti nel pesce zebra eys-KO. Un test biochimico ha inoltre indicato una sovrastimolazione indotta dalla luce in assenza di eys, portando ad un aumento della produzione di specie reattive dell’ossigeno che sono dannose per le cellule se non risolte dai meccanismi citoprotettivi.
I ricercatori hanno anche scoperto che la stimolazione luminosa innesca la morte delle cellule fotocettrici negli organoidi retinici EYS-KO e hanno inoltre dimostrato che la luce blu è particolarmente letale.
Nel complesso, utilizzando organoidi retinici derivati da cellule iPS e un sistema modello di pesce zebra, i ricercatori hanno identificato il meccanismo patogeno alla base della degenerazione retinica nell’EYS-RD. Anche se resta da vedere come questi risultati possano essere tradotti praticamente in cure preventive, il gruppo di ricerca ha rivelato la citotossicità dipendente dalla luce, in particolare dalla luce blu ad alta intensità, in assenza della proteina EYS completamente funzionale, suggerendo così un potenziale modo per la salvaguardia contro la degenerazione retinica consiste nel limitare l’esposizione alla luce tramite occhiali colorati o altri dispositivi di protezione.
Fonte: JCI Insight