(Microbioma-Immagine Credit Fabio Buonocore Nature).
Gli scienziati stanno iniziando a capire come il microbioma intestinale può influire sulla salute del cervello. Ciò potrebbe portare a trattamenti migliori per le malattie del cervello.
Nel 2006, subito dopo aver avviato il suo laboratorio, la neuroscienziata Jane Foster ha scoperto qualcosa che, secondo lei, avrebbe messo in fermento il suo campo. Lei e il suo team stavano lavorando con due gruppi di topi: uno con una sana selezione di microrganismi nell’intestino e uno privo di microbioma. Hanno notato che i topi senza batteri intestinali sembravano meno ansiosi dei loro equivalenti sani. Quando collocati in un labirinto con alcuni sentieri aperti e alcuni murati, hanno preferito i percorsi esposti. I batteri nell’intestino sembravano influenzare il loro cervello e il loro comportamento.
John Cryan, neuroscienziato all’University College di Cork in Irlanda, si è unito a questo campo di ricerca più o meno nello stesso periodo di Foster. Migliaia di pubblicazioni negli ultimi dieci anni hanno rivelato che i trilioni di batteri nell’intestino potrebbero avere effetti profondi sul cervello e potrebbero essere legati a tutta una serie di disturbi.
Vedi anche:Alzheimer e microbioma: confermato il legame
Finanziatori come il National Institutes of Health degli Stati Uniti stanno investendo milioni di dollari nell’esplorazione di questa connessione.
“Ma insieme a quell’esplosione di interesse è arrivata la campagna pubblicitaria. Alcuni ricercatori del collegamento intestino-cervello affermano o implicano relazioni causali quando molti studi mostrano solo correlazioni e anche traballanti”, afferma Maureen O’Malley dell’Università di Sydney in Australia che lavora nel campo della ricerca sul microbioma. “Hai trovato una causa reale o hai trovato solo un altro effetto?”.
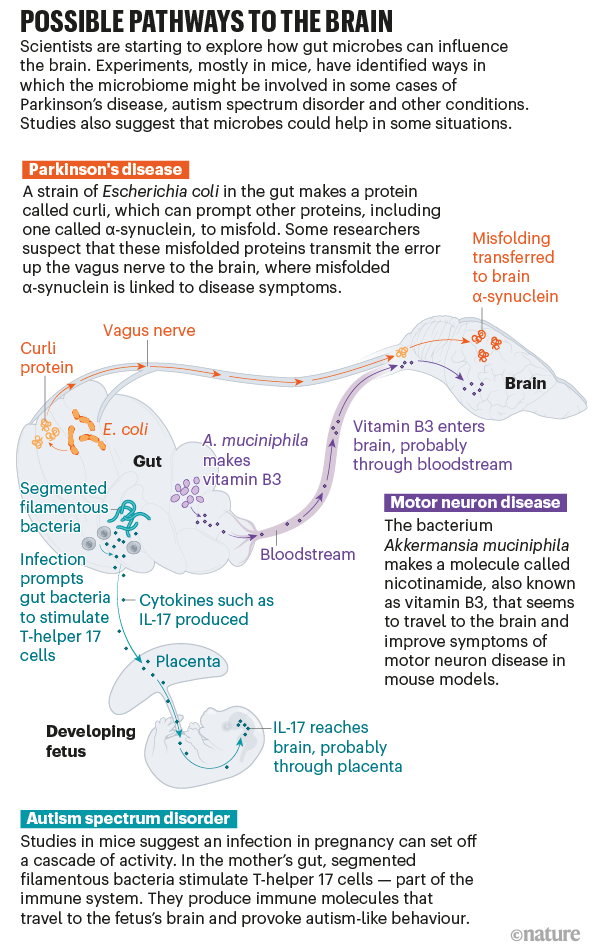
“Negli ultimi anni, tuttavia, il campo ha fatto passi da gigante”, afferma O’Malley. Piuttosto che parlare del microbioma nel suo insieme, alcuni team di ricerca hanno iniziato a scavare per identificare microbi specifici, mappando i percorsi complessi e talvolta sorprendenti che li collegano al cervello. “Questo è ciò che consente di effettuare attribuzioni causali”, afferma. Studi sui topi – e lavori preliminari sugli esseri umani – suggeriscono che i microbi possono innescare o alterare il corso di condizioni come il morbo di Parkinson, il disturbo dello spettro autistico e altro (vedere “Possibili percorsi per il cervello”). Le terapie volte a modificare il microbioma potrebbero aiutare a prevenire o curare queste malattie, un’idea che alcuni ricercatori e aziende stanno già testando in studi clinici sull’uomo.
Credito: Nik Spencer / Nature
“Siamo agli inizi, ma la prospettiva di nuove terapie per alcune di queste malattie cerebrali intrattabili è eccitante”, afferma Sarkis Mazmanian, microbiologo presso il California Institute of Technology di Pasadena, soprattutto considerando quanto sia più facile manipolare l’intestino che il cervello. “Portare le terapie nel cervello è stata una sfida di lunga data”, dice, “ma puoi sicuramente cambiare il microbioma”.
Trasmissione dei grovigli α-sinucleina
Nel 1817, il chirurgo inglese James Parkinson descrisse alcuni dei primi casi di “paralisi tremante” che sarebbe diventata nota come morbo di Parkinson. Un individuo aveva sviluppato intorpidimento e sensazioni di formicolio in entrambe le braccia. Parkinson ha notato che l’addome dell’uomo sembrava contenere un “accumulo considerevole”. Ha somministrato all’uomo un lassativo e dieci giorni dopo le sue viscere erano vuote e i suoi sintomi erano scomparsi. Alcune persone che sviluppano la malattia soffrono di stitichezza molto prima di sviluppare problemi di mobilità. E molti ricercatori hanno abbracciato l’idea che la malattia inizi nell’intestino, almeno in alcuni casi.
Per capire l’idea, è utile conoscere un po’ la malattia. I sintomi caratteristici del Parkinson – tremori, rigidità e lentezza dei movimenti – compaiono quando i neuroni responsabili del coordinamento del movimento iniziano a morire. Perché questi neuroni muoiono non è del tutto chiaro, ma una proteina nota come α-sinucleina sembra avere un ruolo chiave. Nelle persone con malattia di Parkinson, la proteina si ripiega male. La prima proteina mal ripiegata causa più ripiegamento errato, fino a quando nel cervello iniziano a formarsi grumi nocivi noti come corpi di Lewy.
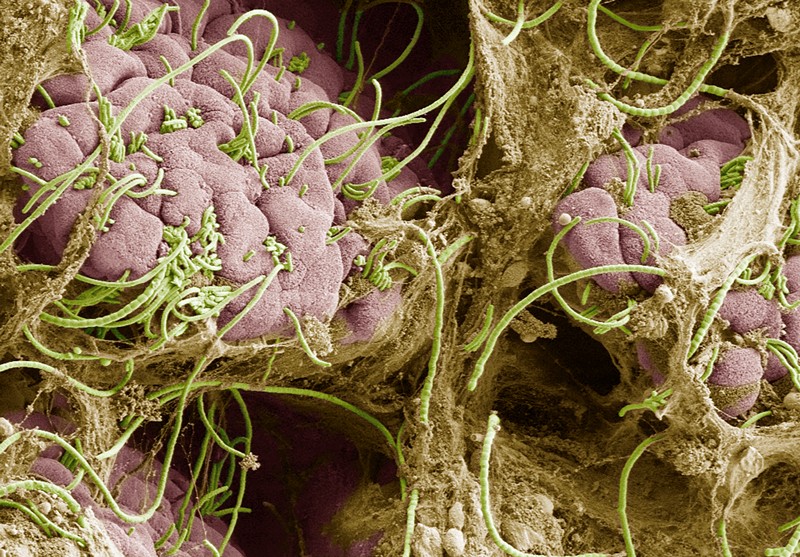
Cosa fa scattare questa cascata? Nel 2015, Robert Friedland, neurologo dell’Università di Louisville nel Kentucky, ha proposto una nuova teoria. Aveva letto che i batteri intestinali possono produrre proteine che hanno una struttura simile alle proteine deformi dell’α-sinucleina, quindi ha ipotizzato che le proteine batteriche potrebbero fornire un modello per il ripiegamento errato. E quando lui e i suoi colleghi hanno nutrito i ratti con un particolare ceppo di Escherichia coli che produce una di queste proteine aggreganti, chiamate curli, nell’intestino, hanno visto più accumulo di α-sinucleina nel cervello degli animali. Il lavoro pubblicato lo scorso anno da Mazmanian e dal suo team supporta la teoria di Friedland.
Non è ancora chiaro come quel segnale nell’intestino raggiunga il cervello, ma un probabile condotto è il nervo vago. Il vago collega il tronco cerebrale a molti organi, compreso il colon ed è il più lungo dei dodici nervi cranici che trasportano i segnali tra il cervello e il resto del corpo. “È davvero un’autostrada”, dice Cryan. E la ricerca su esseri umani e animali suggerisce che ha un ruolo cruciale nel traghettare almeno alcuni messaggi tra l’intestino e il cervello”.
Negli anni ’70, una terapia comune per le ulcere gastriche era quella di rimuovere tutto o parte del nervo per frenare la produzione di acido nello stomaco. Ma negli ultimi decenni, i ricercatori hanno notato uno strano effetto collaterale: le persone che si erano sottoposte a questa procedura sembravano essere meno suscettibili al morbo di Parkinson.
In uno studio sui topi, l’iniezione di α-sinucleina mal ripiegata nell’intestino l’ha prodotta nel cervello. Ma se i ricercatori prima hanno rimosso il nervo vago, nel cervello non è comparsa alcuna α-sinucleina. La stessa α-sinucleina iniettata sembra rimanere nell’intestino, ma Valina Dawson, neuroscienziata della Johns Hopkins University di Baltimora, nel Maryland, autrice dello studio, pensa che potrebbe esserci un effetto domino: le proteine mal ripiegate trasmettono l’errore lungo il nervo vago fino a quando le proteine nel cervello alla fine si ripiegano male. Mazmanian e i suoi colleghi stanno ora conducendo esperimenti per vedere se la proteina curli nell’intestino può ancora provocare i sintomi del Parkinson nei topi che hanno avuto il nervo vago reciso.
Poiché le proteine mal ripiegate sono un segno distintivo di molte altre condizioni che colpiscono il cervello, tra cui il morbo di Alzheimer e la malattia dei motoneuroni (sclerosi laterale amiotrofica o SLA), Friedland afferma che le proteine batteriche potrebbero anche essere implicate in queste malattie. Dawson trova l’idea plausibile, ma afferma che gli amiloidi batterici non sono l’unico fattore da considerare. Il Parkinson, ad esempio, è una malattia complessa che si presenta in modo diverso in persone diverse. Tuttavia, dice, “questo potrebbe essere un modo per iniziare”.
Declino accelerato
I sostenitori del collegamento intestino-cervello affermano che il microbioma potrebbe fare di più che innescare alcuni casi di malattie neurodegenerative: potrebbe anche avere effetti sulla sua gravità. Eran Elinav, immunologo presso il Weizmann Institute of Science di Rehovot, in Israele, e il German Cancer Research Center di Heidelberg, è rimasto colpito dalle differenze nel modo in cui la SLA può svilupparsi: alcune persone con la malattia progrediscono lentamente e altre si deteriorano rapidamente. Elinav si è chiesto se il microbioma aiuta a spiegare queste differenze, quindi lui e il suo team hanno iniziato a lavorare con uno dei modelli murini di SLA più comuni. Quando hanno spazzato via il microbioma con antibiotici o hanno utilizzato topi privi di microbioma dalla nascita, hanno visto una progressione della malattia molto più rapida rispetto ai topi con un microbioma normale.
Il team ha confrontato i batteri intestinali nei topi SLA con quelli dei loro cuccioli sani e ha trovato diverse specie microbiche che sembravano essere collegate alla malattia. Hanno trapiantato meticolosamente quelle specie, una per una, in un altro gruppo di topi senza batteri intestinali, identificando due specie che peggioravano i sintomi della SLA e una che sembrava migliorarli. “E poi ci siamo chiesti come fa questo ceppo che vive solo nell’intestino ad avere un impatto così sorprendente su una malattia che si concentra sul cervello”, dice Elinav.
I batteri filamentosi segmentati nell’intestino (verdi) stimolano eccessivamente il sistema immunitario dei topi gravidi che hanno un’infezione, alterando lo sviluppo del cervello del feto. Credito: Dan Littman, Alice Liang, Doug Wei e Eric Roth.
I colpevoli potrebbero essere metaboliti batterici: piccole molecole prodotte dai batteri che possono entrare nel flusso sanguigno e viaggiare nel corpo. “Almeno la metà di tutte le piccole molecole nel sangue sono “prodotte da microbi o modulate da microbi”, dice Elinav. Lui e il suo team hanno analizzato i metaboliti prodotti dal microbo benefico e ne hanno somministrato uno, una molecola chiamata nicotinamide, nota anche come vitamina B3, ai topi inclini alla SLA. Hanno scoperto che la molecola è entrata nel cervello e ha migliorato i sintomi.
Quando hanno confrontato i microbiomi delle persone con SLA e quelli dei loro familiari non affetti, hanno visto meno nicotinamide negli individui con SLA. Il metabolita è prontamente disponibile come integratore ed Elinav dice che lui e i suoi colleghi stanno pianificando una sperimentazione clinica con esso.
Almeno un gruppo ha già testato la vitamina B3 come trattamento per la SLA in un piccolo studio, sebbene in una versione combinata con un altro composto. I ricdercatori l’hanno somministrato a partecipanti con SLA per quattro mesi. Quelli nel gruppo di trattamento hanno mostrato qualche miglioramento, ma quasi tutte le persone nel gruppo placebo hanno perso la salute.
“Questo è solo l’inizio”, dice Elinav. Esistono molti più batteri e metaboliti e ogni cellula del corpo è aperta ai loro effetti. Una volta che te ne accorgi”, dice, “inizi a capire che l’effetto del microbioma potrebbe espandersi ben oltre il luogo in cui vivono effettivamente i microbi”.
Fonte: Nature