SM-Immagine Credit Public Domain-
La degenerazione della mielina, una guaina isolante necessaria per una rapida comunicazione tra le cellule nervose e la neuroinfiammazione sono segni distintivi notevoli della sclerosi multipla (SM) e dei disturbi neurodegenerativi correlati come il morbo di Alzheimer e il morbo di Huntington, che colpiscono circa 2,8 milioni di persone nel mondo. Tuttavia, si sa poco sui precisi passaggi molecolari attraverso i quali la demielinizzazione porta alla perdita di neuroni e glia, i due principali tipi di cellule cerebrali.
Un articolo pubblicato di recente su Cell Metabolism da un gruppo di ricerca guidato dai Drs. Hugo J. Bellen, Hyunglok Chung e Hyun Kyoung Lee del Jan and Dan Duncan Neurological Research Institute (Duncan NRI) del Texas Children’s Hospital e del Baylor College of Medicine, fa luce proprio sulla demielinzzazione.
I ricercatori hanno scoperto che la disgregazione della mielina si traduce in un accumulo di acidi grassi a catena molto lunga (VLCFA) e dei loro intermedi che innesca una risposta autoimmune che danneggia le cellule cerebrali. Inoltre, i ricercatori hanno dimostrato che la riduzione dei livelli di VLCFA utilizzando farmaci noti, Bezafibrato e Fingolimod, ha avuto un effetto benefico sinergico sulle patologie della SM in un modello animale, rivelando un trattamento ancora più efficace per i pazienti con SM.
Il ruolo del gene dACOX1 nella SM
Uno studio precedente del laboratorio Bellen ha dimostrato che la perdita della versione moscerino del gene dACOX1 riduceva la durata della vita, causava disfunzioni neuronali e motorie e alla fine provocava la scomparsa di neuroni e glia. Il gene ACOX1 codifica un enzima necessario per la scomposizione di VLCFA. In questo studio, i ricercatori si sono proposti di comprendere gli esatti passaggi molecolari attraverso i quali l’assenza di dACOX1 provoca la perdita di neuroni e glia.
Vedi anche:SM: una tossina batterica può innescare l’insorgenza e la ricaduta
I VLFCA sono un raro gruppo di acidi grassi che costituiscono solo una piccola frazione degli acidi grassi totali nel corpo. Le guaine mieliniche che circondano le membrane nervose sono una ricca fonte di VLCFA e hanno livelli circa 10 volte superiori di VLCFA-ceramidi rispetto ad altre membrane cellulari. I VLCFA sono prodotti da acidi grassi a catena lunga dall’enzima elongasi degli acidi grassi ELOVL e riconvertiti dall’enzima ACOX1.
Il Dottor Chung, un ex borsista post-dottorato del laboratorio Bellen, che è anche il primo e co-corrispondente autore di questo studio, ha scoperto che gli effetti tossici osservati a causa della perdita di dACOX1 potrebbero essere soppressi abbattendo il gene che codifica ELOVL con Bezafibrato, un farmaco ipolipemizzante. Queste osservazioni hanno ulteriormente supportato le loro precedenti osservazioni secondo cui l’eccesso di VLCFA è dannoso per le cellule nervose.
Il Dottor Chung e colleghi hanno poi valutato come l’aumento dei livelli di VLCFA nella glia influenzi il metabolismo di altri lipidi. Hanno eseguito un’analisi spettrometrica di massa di 26 lipidi ottenuti da teste di mosche adulte a cui mancava la versione della mosca del gene ACOX1. Hanno scoperto che due intermedi lipidici – ceramidi molto lunghi (VL-Ceramidi) e sfingosina-1-fosfato (S1P) – erano significativamente più alti nella glia di queste mosche.
Ulteriori studi hanno rivelato che l’eccesso di S1P gliale veniva trasportato ai neuroni e questo aumento dei livelli di S1P era dannoso per la sopravvivenza sia della glia che dei neuroni ed era sufficiente a causare il malfunzionamento e la degenerazione di queste cellule. In particolare, hanno scoperto che l’integrazione delle mosche mutanti dACOX1 con Fingolimod, un farmaco per la SM noto per legare e sottoregolare i livelli del recettore S1P, ha portato a notevoli miglioramenti nella vitalità complessiva, nella funzione neuronale e, soprattutto, nella neurodegenerazione ritardata in queste mosche.
Insieme, questi dati forniscono prove convincenti che l’accumulo di S1P, un prodotto chiave del catabolismo VLCFA, è la causa principale della scomparsa della glia e dei neuroni nei mutanti dACOX1.
S1P innesca forti risposte immunitarie che distruggono le cellule cerebrali nelle mosche
La forte soppressione dei sintomi neurodegenerativi nelle mosche mutanti dACOX1 da parte del Fingolimod, un farmaco usato per trattare la SM, una malattia autoimmune, ha spinto il Dottor Chung a esplorare se VLCFA elevato avesse un impatto sulle risposte immunitarie.
Curiosamente, il ricecatore ha osservato che le mosche prive di ACOX1 avevano diverse grandi masse melanotiche nere in tutto il corpo, tra cui la testa, gli occhi, i margini delle ali e l’addome. Tipicamente, la melanizzazione è una reazione immunitaria immediata dispiegata negli artropodi come le mosche quando vengono attaccati da agenti patogeni e parassiti. Tuttavia, la presenza di masse melanotiche in queste mosche ha suggerito che l’assenza di dACOX1 induce una risposta autoimmune per cui le cellule immunitarie interpretano erroneamente la presenza di una molecola innocua come un segno di un’invasione cellulare e montano un attacco ingiustificato che distrugge le proprie cellule.
Successivamente i ricercatori hanno verificato la perdita di dACOX1 attivasse anche altre vie immunitarie.
Le mosche hanno due principali vie immunitarie – le vie del pedaggio e dell’immunodeficienza (Imd) – che controllano le risposte immunitarie inducibili a batteri e funghi invasori mediante la produzione sistemica di citochine e peptidi antimicrobici (AMP) all’attivazione del fattore nucleare-kB (NF -KB).
In particolare, gli autori hanno scoperto che un elevato livello di S1P nella glia attiva NF-kB che a sua volta aumenta significativamente i livelli di trascrizione di diversi geni AMP coinvolti nella via IMD. Inoltre, le cellule immunitarie circolanti vengono reclutate nel sistema nervoso centrale.
“Questa è la prima volta che questo percorso immunitario ha dimostrato di portare alla neuroinfiammazione nei moscerini della frutta adulti“, ha affermato il Dottor Bellen, un Professore del Baylor.
Bezafibrato e Fingolimod migliorano la progressione dei sintomi della SM nei topi
Entusiasti di questi risultati, il team ha quindi esplorato il ruolo di VLCFA e S1P elevati nella progressione della SM nei vertebrati collaborando con il Dr. Hyun Kyoung Lee, professore associato presso il Baylor e ricercatore presso il Duncan NRI. Il modello di vertebrato più comunemente usato per studiare la SM è l’encefalomielite autoimmune sperimentale (EAE) in cui ai topi viene iniettata la mielina per indurre patologie simili alla SM e risposte immunitarie.
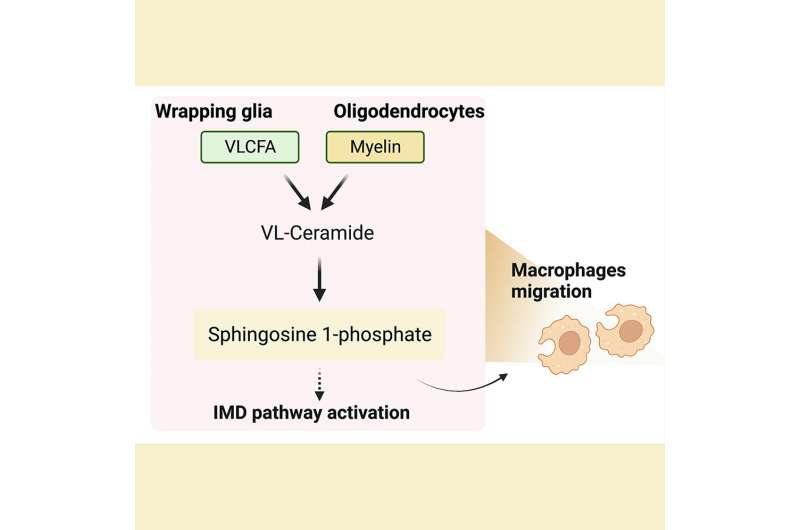
Immagine:astratto grafico Credito: Cell Metabolism (2023).
In primo luogo, un borsista post-dottorato nel laboratorio di Lee e co-primo autore, il Dottor Qi Ye, ha scoperto che il trattamento pre-sintomatico di questi topi con Bezafibrato, un farmaco ipolipemizzante che inibisce la sintesi di VLCFA, ha rallentato la progressione della patologia EAE riducendo la demielinizzazione, il danno neuronale e l’infiltrazione di cellule immunitarie nel cervello. Questi risultati hanno dimostrato che questo farmaco può rallentare la progressione di questo disturbo debilitante.
Successivamente i ricercatori hanno testato il potenziale effetto terapeutico dell’abbassamento dei livelli di VLCFA e S1P sulla SM. “Quando abbiamo somministrato Bezafibrato insieme a Fingolimod all’inizio dei sintomi, abbiamo visto un miglioramento sinergico della paralisi indotta da EAE e delle prestazioni motorie, della demielinizzazione e della perdita neuronale. Gli effetti combinati di questi farmaci erano significativamente migliori dell’effetto di entrambi i farmaci da soli in ogni parametro che abbiamo testato, suggerendo che una terapia combinata sarà più efficace e offrirà risultati migliori per i pazienti con SM”, ha aggiunto il Dott. Chung.
“Siamo molto entusiasti delle potenziali implicazioni cliniche di questo studio non solo per il modo in cui trattiamo i pazienti con SM, ma anche per altre condizioni neurodegenerative associate a demielinizzazione, interruzioni del metabolismo lipidico e neuroinfiammazione”, ha affermato il Dott. Bellen.
Il Dottor Chung ha in programma di esplorare ulteriormente il meccanismo di trasporto di S1P nel suo nuovo ruolo di assistente professore nel dipartimento di neurologia presso la Houston Methodist.
Altri coinvolti nello studio erano Qi Ye, Ye-Jin Park, Zhongyuan Zuo, Jung-Wan Mok, Oguz Kanca, Sudhir Gopal Tattikota, Shenzhao Lu, Nobert Perrimon e Hyun Kyoung Lee.
Fonte:Cell Metabolism