Nel lievito affamato esposto a stress termico, un calo transitorio del pH intracellulare aiuta a innescare la risposta allo shock termico secondo uno studio condotto da Anderson UTHealth Graduate School of Biomedical Sciences, University of Texas, Stati Uniti.
Chi non ha mai avuto una giornata stressante al lavoro? In modalità di crisi, in genere garantiamo la sopravvivenza professionale abbandonando tutto e reindirizzando tutte le nostre risorse alle attività più importanti, persino arruolando personale di supporto specializzato per portare a termine il lavoro. Dal lievito all’uomo, la maggior parte delle cellule eucariotiche adotta la stessa strategia. Quando esposti a fattori di stress fisiologici che possono impedire alle loro proteine di piegarsi correttamente, fanno appello a chaperon molecolari che possono riconoscere le proteine danneggiate o mal ripiegate e assistere nella loro rimozione o riparazione.
In particolare, eventi come il caldo estremo, la fame o le sostanze tossiche possono attivare Hsf1, il fattore di trascrizione che controlla il programma genetico che coordina la creazione degli chaperon.
Questo programma, chiamato risposta allo shock termico, viene interrotto in assenza di stress. Ma come fanno le cellule a “sapere” quando indurlo?
Tre decenni fa Betty Craig e Carol Gross dell’Università del Wisconsin-Madison hanno proposto che, direttamente o indirettamente, il fattore scatenante avrebbe coinvolto proteine mal ripiegate che interagivano con gli chaperon, in particolare uno noto come Hsp70. Lavori recenti hanno ampiamente convalidato questa ipotesi: Hsp70 si lega a Hsf1 per bloccarne l’attività, fino a quando la concentrazione di proteine mal ripiegate aumenta così tanto da allontanare Hsp70 da Hsf1. In questo processo, le proteine giovanili che vengono appena tradotte agiscono come il principale innesco di Hsp70, poiché sono squisitamente sensibili ai cambiamenti ambientali e tendono a piegarsi facilmente. Tuttavia, le cellule affamate – in cui la traduzione è fortemente ridotta – possono ancora montare una modesta risposta allo shock termico, suggerendo che questo modello pulito e ordinato è in realtà incompleto. Ora, in eLife, Allan Drummond e colleghi dell’Università di Chicago – tra cui Catherine Triandafillou come prima autrice – riportano un nuovo percorso indipendente dalla traduzione che innesca la risposta allo shock termico nella specie di lievito Saccharomyces cerevisiae .
Questo percorso si basa sul fatto che temperature elevate portano a un calo temporaneo del pH delle cellule. Per indagare su come l’acidificazione è collegata alla risposta allo shock termico, il team ha sviluppato metodi sofisticati e sensibili per monitorare “in tempo reale” sia il pH che i prodotti della risposta allo shock termico all’interno delle singole cellule di lievito. Ciò è stato ottenuto sfruttando le letture della fluorescenza riportate dalla citometria a flusso. Inoltre, il pH delle cellule è stato “bloccato” a valori specifici.
Insieme, questi approcci hanno confermato che quando le cellule di lievito sono improvvisamente esposte a una temperatura di 42 ° C, il loro pH interno scende (da circa 7,5 a 6,8) e la loro risposta allo shock termico viene attivata. In condizioni nutritive normali, la prevenzione dell’acidificazione ha avuto scarso effetto sulla risposta allo shock termico. Tuttavia, farlo quando il lievito mancava di glucosio ha praticamente abolito la risposta e lo stesso effetto è stato osservato nelle cellule in cui la traduzione era bloccata. Fondamentalmente, gli esperimenti di sequenziamento dell’RNA hanno mostrato che una mancanza di acidificazione ha solo fermato la risposta allo shock termico, in particolare spegnendo i geni controllati da Hsf1; la trascrizione globale non è stata influenzata e nemmeno un percorso di risposta allo stress parallelo governato dai fattori di trascrizione Msn2 / 4.
L’acidificazione cellulare non aveva bisogno di avvenire contemporaneamente allo stress termico, poiché una riduzione del pH post-stress ha salvato la potenza della risposta allo shock termico. Inoltre, i livelli di pH dovevano tornare ai livelli pre-stress affinché la risposta allo shock termico fosse ottimale, suggerendo che l’acidificazione a lungo termine potrebbe essere dannosa. Infine, il team ha esaminato se l’acidificazione fosse necessaria per la sopravvivenza cellulare. Le cellule che non potevano regolare il loro pH durante lo shock termico sono sopravvissute, ma saggi di crescita competitivi hanno mostrato che sono entrate nel ciclo cellulare più lentamente e che alla fine sono state superate dalle cellule che potevano acidificarsi.
Il lavoro di Triandafillou et al. scopre un meccanismo che consente alle cellule che non si stanno traducendo attivamente di rispondere allo stress termico e di persistere in una popolazione. Sebbene la combinazione di shock termico e fame sia rara in laboratorio, è probabilmente comune per il lievito selvatico. Questi organismi giacciono per lo più dormienti e affamati sulla superficie dei frutti durante il giorno, mentre sono esposti a oscillazioni estreme della temperatura ambiente. Questo modo “secondario” per indurre la risposta allo shock termico può anche aiutare il lievito ad affrontare il caldo e la fame che incontrano quando vengono ingeriti accidentalmente da uccelli mangiatori di frutta. Ciò consentirebbe alle cellule di diffondersi in nuove aree geografiche, fornendo ancora un altro mezzo di competitività evolutiva per la specie.
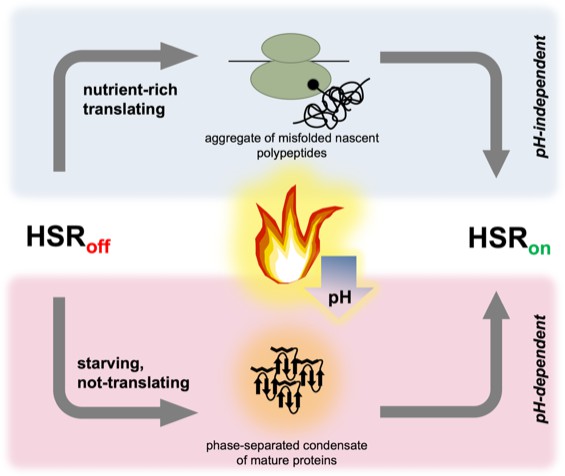
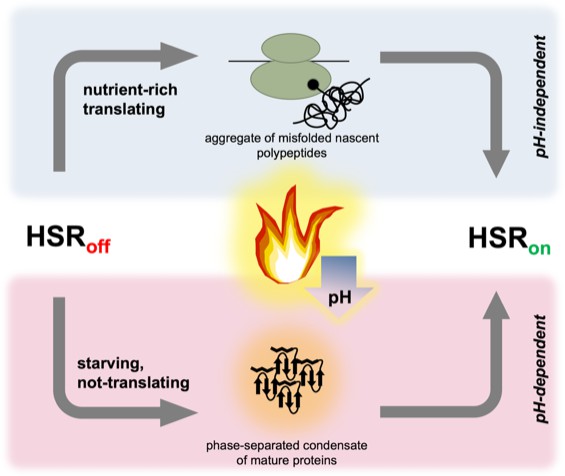
Immagine:Due percorsi paralleli possono indurre la risposta allo shock termico nel lievito. La risposta allo shock termico è controllata dal fattore di trascrizione dello shock termico Hsf1; è repressa (HSR off ) quando le condizioni sono stabili, ma rapidamente indotti (HSR su ) da una temperatura elevata. Nelle cellule “ricche di nutrienti” (in alto), la traduzione è robusta e lo stress termico (fiamma) fa sì che un sottoinsieme di polipeptidi nascenti si ripieghi in modo errato e si aggreghi, attivando infine Hsf1 e la risposta allo shock termico. Quando le cellule stanno morendo di fame (e hanno quindi interrotto la traduzione), la risposta allo shock termico è ancora indotta; il trigger presumibilmente coinvolge proteine mature e ripiegate che si assemblano in strutture separate in fase che possono reclutare chaperon. Lo stress termico porta a un calo del pH (freccia blu) in tutte le cellule, ma solo le cellule affamate richiedono l’acidificazione per attivare la risposta allo shock termico.
Ironia della sorte, questa scoperta riporta il campo al punto di partenza, allo stesso tipo di domanda posta oltre 30 anni fa: cosa innesca questo percorso indipendente dalla traduzione? La risposta potrebbe risiedere nel fenomeno della separazione di fase, in cui all’interno delle cellule possono formarsi compartimenti che non sono racchiusi all’interno di una membrana per ospitare specifici processi biologici. Un lavoro recente ha dimostrato che molte proteine citoplasmatiche possono subire la separazione di fase per formare assemblaggi transitori che sono diversi dagli aggregati normalmente creati dalle proteine misfolding. In particolare, temperatura e pH possono controllare la formazione di queste strutture. Si è quindi tentati di ipotizzare che una o più di tali proteine, o forse gli assemblaggi stessi, siano riconosciute da Hsp70 per attivare la risposta allo shock termico. Questi substrati ora attendono l’identificazione.
Fonte: eLife sciences