“La risposta immunitaria è davvero importante per il controllo del cancro, ma è stata trascurata per decenni”, afferma Anna Wilkins, consulente urologica sul cancro presso il Royal Marsden e ricercatrice clinica presso l’Institute of Cancer Research di Londra.
Non più. Negli ultimi due decenni, i ricercatori hanno prestato maggiore attenzione alla coevoluzione dei tumori e del sistema immunitario. “Ora sappiamo che il grado di infiltrazione delle cellule immunitarie in un tumore influenza la sua crescita e il modo in cui può essere trattato“, aggiunge Wilkins.
Poiché le immunoterapie diventano un trattamento di prima linea per diversi tumori, gli oncologi riconoscono che una comprensione più profonda della posizione e dell’interazione delle sottopopolazioni di cellule immunitarie all’interno del microambiente tumorale (TME) è cruciale per guidare lo sviluppo di nuove terapie e l’uso di quelle esistenti.
Nonostante le solide prove che siano necessari più biomarcatori per indicare se i pazienti affetti da cancro risponderanno all’immunoterapia, la maggior parte delle decisioni terapeutiche si basano sul rilevamento di solo uno o due marcatori per sezione di tessuto utilizzando l’immunoistochimica convenzionale.
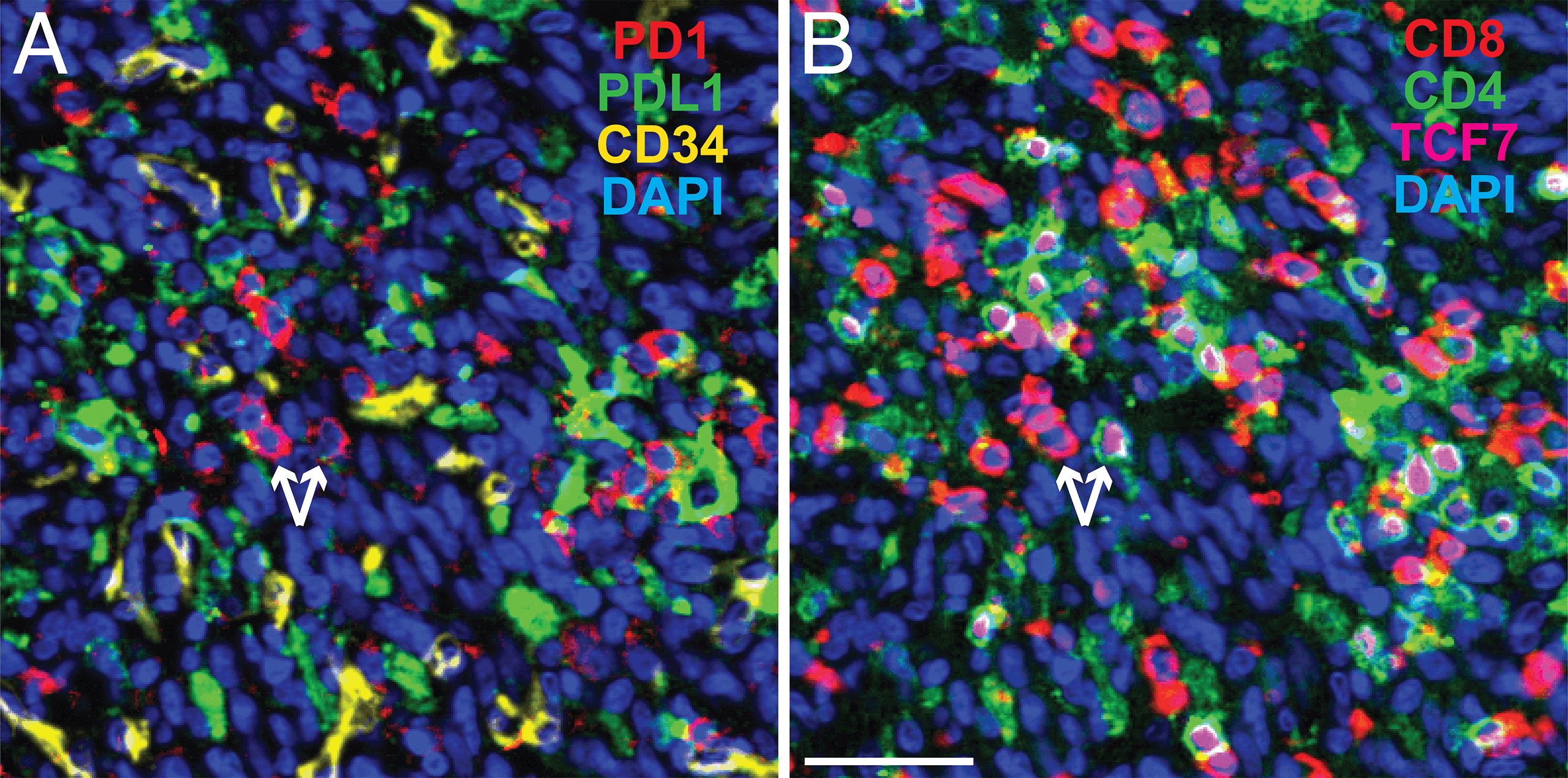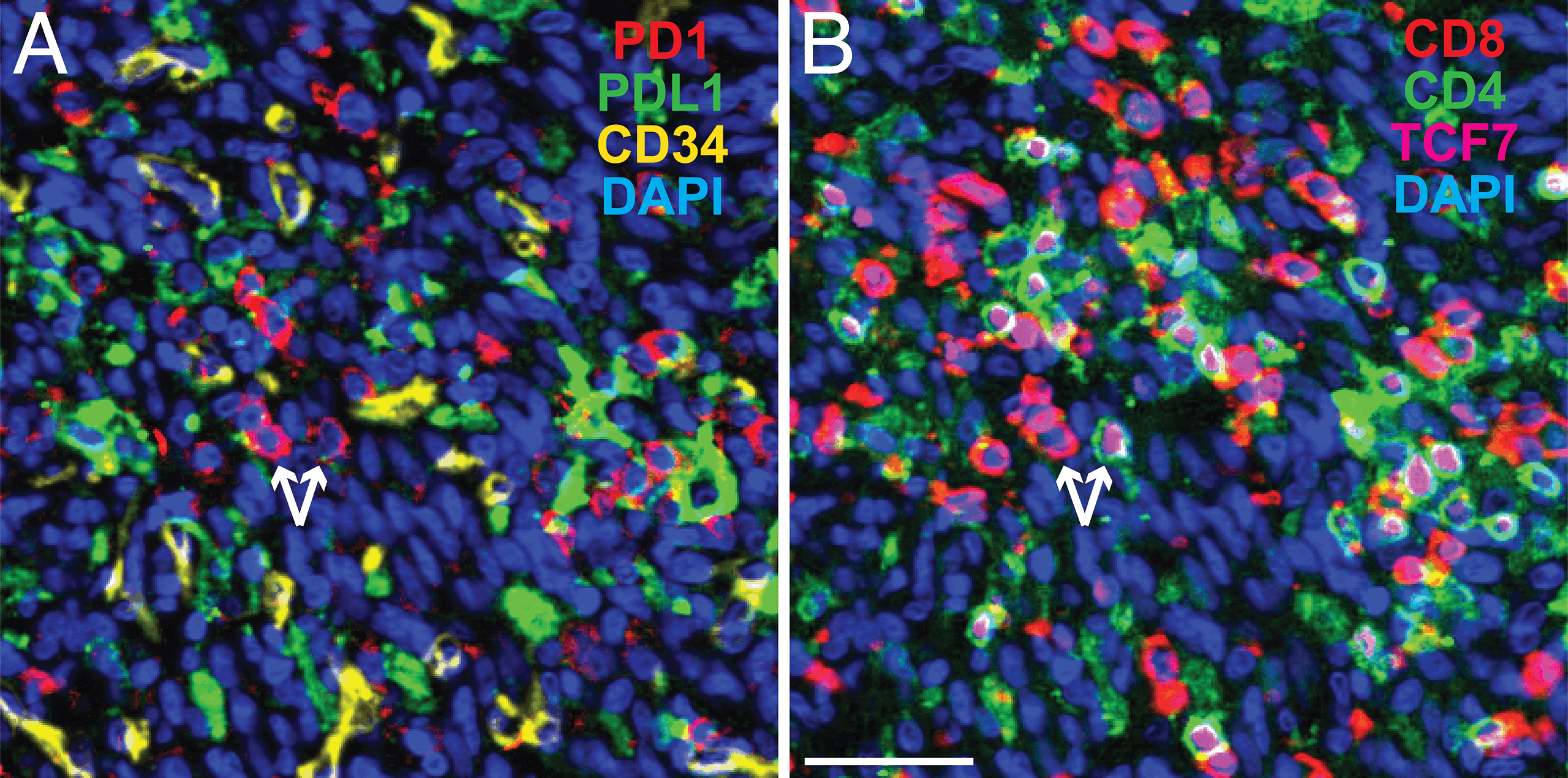
Le tecniche di imaging multiplex comportano il rilevamento simultaneo di più marcatori su una singola sezione di tessuto. Questo approccio migliora enormemente l’analisi spaziale delle cellule e delle strutture che circondano immediatamente un tumore.
“Il multiplexing fornisce una panoramica della battaglia tra le cellule tumorali e il sistema immunitario, cosa impossibile quando si colorano solo uno o due marcatori“, afferma Carlo Bifulco, Direttore medico di patologia molecolare oncologica e informatica patologica presso il laboratorio regionale di Providence, Oregon.
I progressi nei metodi di immunoistochimica/immunofluorescenza multiplex (m-IHC/IF), inclusi nuovi coloranti e colorazione ciclica, insieme a utili indicazioni sulle migliori pratiche, stanno consentendo agli scienziati di rilevare un numero crescente di marcatori con elevata precisione e accuratezza.
“Scegliamo terapie basate su una quantità molto piccola di informazioni biologiche quando ci sono molti più dati che potremmo utilizzare“, afferma Wilkins. “C’è un enorme potenziale per fare meglio”.
Approcci di imaging multiplex
Gli anticorpi che si legano specificamente e selettivamente al bersaglio di interesse sono fondamentali per il rilevamento delle proteine in situ. I metodi di imaging basati su anticorpi multiplex sono classificati in base al tipo di coniugato anticorpale e alla modalità di rilevamento. L’imaging m-IHC/IF di anticorpi coniugati con fluorofori, oligonucleotidi e/o enzimi reporter, utilizzando un microscopio ottico, è il metodo più consolidato e dispone di un’ampia gamma di reagenti e sistemi di imaging.
Il patologo Giorgio Cattoretti dell’Università di Milano-Bicocca, Italia e colleghi a Lovanio hanno sviluppato il metodo MILANO (Multiple Iterative Labeling by Antibody Neodeposition) per immunocolorare sequenzialmente campioni di tessuto fissati in formalina e inclusi in paraffina (FFPE). “Il metodo MILANO è molto versatile e conveniente per studiare il microambiente TME“, afferma.
MILANO si basa su anticorpi primari non coniugati e ampiamente validati e anticorpi secondari coniugati con fluorocromo. “Abbiamo scoperto sperimentalmente che Jackson ImmunoResearch dispone dei migliori reagenti disponibili (e abbiamo testato la maggior parte delle aziende)“, osserva.
Il metodo prevede cicli sequenziali di colorazione, imaging e rimozione degli anticorpi. Una combinazione dell’agente riducente beta-mercaptoetanolo e del detergente sodio dodecil solfato (SDS) smonta e rimuove gli anticorpi legati senza danneggiare il tessuto.
“Abbiamo dimostrato che gli epitopi antigenici vengono preservati dopo più di 30 cicli di colorazione“, afferma Cattoretti. “Inoltre, possiamo riprodurre i risultati nello stesso campione sei mesi dopo con una variazione inferiore al 10% nell’intensità del segnale“.
Con metodi di colorazione ciclica, nuovi coloranti progettati per adattarsi alle lacune spettrali esistenti e migliori apparecchiature di rilevamento, i ricercatori possono facilmente acquisire immagini di dozzine di fluorofori in una singola sezione di tessuto. Tuttavia, devono anche essere consapevoli sia dell’investimento necessario per elaborare i campioni multiplex sia, in ultima analisi, della loro utilità clinica. “Dobbiamo valutare i vantaggi della scansione di grandi aree in modo rapido ed economico per un numero limitato di target rispetto a piattaforme ad altissimo plex che rilevano oltre 100 target e generano quantità fantastiche di dati biologici, ma da piccole aree di tessuto“, afferma Wilkins.
Ricerca clinica cooperativa per il multiplexing multisito
Migliorare la riproducibilità intra e inter-sito dei dati multiplex è essenziale se devono essere utilizzati in clinica. Un’adeguata selezione degli anticorpi, la validazione degli anticorpi, la progettazione del pannello, l’ottimizzazione e la validazione della colorazione e le corrette strategie di raccolta e analisi dei dati sono fondamentali per ridurre al minimo la variabilità tra laboratori. Anche in questo caso, ci sono alcuni aspetti del processo che rendono difficile standardizzare l’imaging m-IHC/IF, come l’uso di diverse procedure di elaborazione dei tessuti e la variabilità tra osservatori.
Diversi progetti di collaborazione mirano ad armonizzare l’imaging multiplex sviluppando flussi di lavoro in grado di fornire dati m-IHC/IF affidabili e comparabili utilizzando campioni di tessuto simili. I risultati della rete Cancer Immune Monitoring and Analysis Centers e Cancer Immunologic Data Commons (CIMAC-CIDC) supportano l’allineamento delle metodologie tra più istituzioni, non applicando protocolli, strumenti e reagenti identici, ma piuttosto garantendo le migliori pratiche e una quantificazione e interpretazione concordanti dei dati.
Ulteriori strumenti sono i pannelli di anticorpi per la mappatura degli organi convalidati dalla comunità: combinazioni di anticorpi che definiscono popolazioni cellulari e strutture anatomiche riproducibili in diversi tessuti di origine umana. Questi pannelli non solo migliorano la standardizzazione, ma fanno anche risparmiare tempo e denaro ai ricercatori nell’esecuzione dell’imaging multiplex . “L’ottimizzazione della selezione del pannello di anticorpi è fondamentale per apprezzare la complessità biologica della TME e accelerare le conoscenze biologiche ottenute dall’imaging dei tessuti multiplex”, aggiunge Cattoretti.
Diverse iniziative globali mirano a ricavare liste di controllo basate sul consenso per la convalida e il reporting dei dati m-IHC/IF. Bifulco aiuta a organizzare il gruppo di interesse speciale sull’immunofluorescenza multiplex (MxIF-SIG) della Society for Immunotherapy of Cancer (SITC). Sottolinea l’importanza degli sforzi della comunità per tradurre i progressi nell’imaging multiplex della TME in migliori esiti del cancro. Egli attribuisce i miglioramenti in termini di robustezza e riproducibilità di m-IF all’innovazione in ogni fase del processo, dalle piattaforme e protocolli di colorazione alle piattaforme di acquisizione e analisi delle immagini.
Il SITC ha già pubblicato una dichiarazione sulle migliori pratiche per la colorazione e la validazione di m-IHC/IF e presto ne rilascerà un’altra sulle migliori pratiche per riportare i dati ottenuti. “Il settore è in forte espansione in questo momento”, afferma Bifulco. “Lo scopo di questi documenti guida è migliorare la qualità dei documenti presentati e pubblicati”.
Leggi anche:La nano-radiomica svela l’effetto del trattamento sul microambiente tumorale
Wilkins è entusiasta degli sviluppi nel campo, in particolare di come gli algoritmi di apprendimento automatico per le immagini miglioreranno la comprensione delle caratteristiche TME clinicamente rilevanti. “Man mano che m-IF verrà integrato con l’omica spaziale e l’analisi avanzata dei dati”, afferma, “saremo in grado di realizzare il suo pieno potenziale, migliorare la selezione dei pazienti e indirizzare scelte terapeutiche personalizzate“.
Fonte: Nature