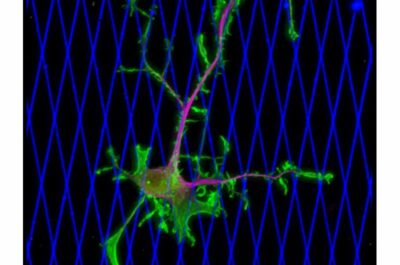
Cancro al seno-Immagine: una cellula di cancro al seno umano, l’adenocarcinoma MDA-MB-231, dimostra un’adesione di tipo metastatico, diffondendosi e migrando in una matrice di collagene progettata per imitare i tessuti molli.
Una nuova ricerca condotta dalla Penn State rivela per la prima volta i meccanismi alla base del modo in cui le cellule del cancro al seno possono invadere i tessuti sani. La scoperta, che mostra che una proteina motrice chiamata dineina alimenta il movimento delle cellule tumorali nei modelli di tessuti molli, offre nuovi bersagli clinici contro le metastasi e ha il potenziale per cambiare radicalmente il modo in cui viene trattato il cancro. Credito: Erdem Tabdanov
La caratteristica più letale di qualsiasi cancro è la metastasi, la diffusione delle cellule tumorali in tutto il corpo. Una nuova ricerca condotta dalla Penn State University rivela per la prima volta i meccanismi alla base del modo in cui le cellule del cancro al seno possono invadere i tessuti sani. La scoperta, che mostra che una proteina motrice chiamata dineina alimenta il movimento delle cellule tumorali nei modelli di tessuti molli, offre nuovi bersagli clinici contro le metastasi e ha il potenziale per cambiare radicalmente il modo in cui viene trattato il cancro.
“Questa scoperta segna un cambiamento di paradigma in molti modi”, ha affermato Erdem Tabdanov, assistente Professore di farmacologia alla Penn State e autore principale e co-corrispondente dello studio, recentemente pubblicato sulla rivista Advanced Science. “Fino ad ora, la dineina non è mai stata coinvolta nel fornire la forza meccanica per la motilità delle cellule tumorali, che è la loro capacità di muoversi. Ora possiamo vedere che se si prende di mira la dineina, si potrebbe effettivamente fermare la motilità di quelle cellule e, pertanto, interrompere la diffusione metastatica“.
Il progetto è iniziato come collaborazione tra il Dipartimento di ingegneria chimica della Penn State e il Penn State College of Medicine, prima di trasformarsi in una partnership multi-istituzionale con ricercatori del Medical Center dell’Università di Rochester, del Georgia Institute of Technology, della Emory University e dell’US Food e Amministrazione farmaceutica.
I ricercatori hanno utilizzato la microscopia dal vivo per osservare la migrazione delle cellule vive del cancro al seno in due diversi sistemi modellati sul corpo umano. Il primo sistema, una rete bidimensionale di fibre di collagene, ha rivelato “come le cellule tumorali si muovono attraverso una matrice extracellulare che circonda i tumori e ha dimostrato che la dineina è la chiave per il movimento delle cellule tumorali“. Il secondo sistema era un modello tridimensionale sviluppato da un team guidato da Amir Sheikhi, Dorothy Foehr Huck e J. Lloyd Huck Early Career Chair in Biomaterials and Regenerative Engineering e assistente Professore di ingegneria chimica e ingegneria biomedica alla Penn State.
Il secondo sistema è stato progettato per imitare i tessuti molli utilizzando una rete di microscopiche particelle di idrogel o microgel collegate tra loro in forme simili a tumori. Come nel modello bidimensionale, i ricercatori hanno scoperto che nel modello tridimensionale la dineina era “indispensabile” nella diffusione o nella metastasi delle cellule tumorali.
“Utilizzando questi modelli tridimensionali che imitano parzialmente un tumore, abbiamo scoperto che se blocchiamo la dineina, le cellule tumorali non possono muoversi efficacemente e infiltrarsi nei tessuti solidi“, ha detto Sheikhi. “In entrambi i modelli, abbiamo scoperto che la dineina è estremamente importante per la locomozione cellulare, il che suggerisce un metodo completamente nuovo per la gestione del cancro. Invece di uccidere le cellule tumorali con radiazioni o chemioterapia, stiamo mostrando come paralizzarle. Questa è un’ottima notizia perché non devi realmente uccidere le cellule, che è un approccio duro che prende di mira sia le cellule cancerose che quelle sane. Invece, devi solo impedire alle cellule tumorali di muoversi“.
Tabdanov ha spiegato: “La “paralisi cellulare” potrebbe rivelarsi una strategia di trattamento del cancro efficace rispetto ai trattamenti chemioterapici, perché dopo la rimozione chirurgica del tumore principale, potrebbe impedire al cancro di diffondersi senza danneggiare i tessuti e le cellule sane“.
“Il trucco della chemioterapia è uccidere le cellule tumorali un po’ più velocemente rispetto al resto del corpo: è una corsa contro il tempo“, ha detto Tabdanov. “La chemioterapia provoca molti danni ai tessuti normali e sani del corpo mentre è impegnata a uccidere il cancro. Se invece contenessimo il cancro, fermandolo sul suo cammino, potremmo mantenere sane le parti sane del corpo”.
I ricercatori hanno notato che qualsiasi potenziale trattamento clinico è ancora lontano, poiché devono ancora eseguire studi sull’uomo o sugli animali. Sheikhi ha depositato numerosi brevetti relativi alla piattaforma del suo team e prevede di utilizzare la tecnologia per studiare una miriade di malattie, inclusi altri tumori.
“Siamo molto entusiasti di questa collaborazione con il Penn State College of Medicine e i nostri laboratori stanno lavorando a stretto contatto su altri progetti“, ha affermato Sheikhi. “Penso che queste piattaforme un giorno potrebbero consentire la medicina personalizzata e il trattamento personalizzato per il cancro e, si spera, per molte altre malattie“.
Leggi anche:Cancro al seno avanzato HER2-positivo: trattamento sistemico delle metastasi cerebrali
Altri autori dell’articolo sono Yerbol Tagay del Penn State College of Medicine; Sina Kheirabadi e Zaman Ataie del Dipartimento di Ingegneria Chimica della Penn State; Rakesh Singh del Centro medico dell’Università di Rochester; Denis Tsygankov del Georgia Institute of Technology e della Emory University; e Olivia Prince, Ashley Nguyen, Alexander Zhovmer e Xuefei Ma della Food and Drug Administration statunitense.
Fonte:Advanced Science