Immagine: tessuto stromale denso che avvolge il cancro del pancreas.CREDIT: TUVESON LAB, CSHL
I ricercatori hanno compiuto un importante passo avanti nella comprensione dei motivi per cui il cancro del pancreas è così difficile da trattare. I pazienti affetti da questa condizione spesso vengono diagnosticati quando la malattia si è già diffusa ad altre parti del corpo e inoltre, i farmaci chemioterapici esistenti sono poco efficaci.
La sopravvivenza media è di soli 6 mesi e il tasso di sopravvivenza a 5 anni è di circa l’8%.
(Vedi anche:Cancro del pancreas: come rendere efficace l’immunoterapia).
Perché i tumori pancreatici così resistente al trattamento? Una ragione è, secondo i ricercatori, che il tessuto che circonda i tumori, chiamato stroma, è molto più denso del tessuto stromale circostante altri tipi di tumore più trattabili. Si pensa che nel tessuto stromale siano contenuti i fattori che aiutano il tumore a sopravvivere e crescere. È importante sottolineare che, nel cancro del pancreas, la densità del tessuto stromale impedisce ai farmaci di raggiungere il tumore e ucciderlo.
David Tuveson, Direttore del Cancer Center al Cold Spring Harbor Laboratory (CSHL), ha condotto la ricerca e insieme al suo team ha pubblicato l’importante scoperta sul ruolo del tessuto stromale nella principale forma di cancro del pancreas chiamato adenocarcinoma del dotto pancreatico, nel Journal of Experimental Medicine.
” La ricerca precedente sul ruolo del tessuto stromale nel cancro del pancreas ha fornito risultati contrastanti e questi risultati ci hanno suggerito che noi ancora non sappiamo abbastanza sullo stroma”, dice Daniel Öhlund, primo autore dell’articolo che ha collaborato con Abram Handly-Santana, postdoc Giulia Biffi e postdoc Ela Elyada.
Lo stroma, nell’adenocarcinoma del dotto pancreatico, diventa ciò che gli scienziati chiamano “desmoplastico.” Il suo denso tessuto fibroso diventa una barriera formidabile che circonda il tumore. E’ costituito da cellule chiamate fibroblasti che producono la parte principale del tessuto connettivo di cui è composto e da una varietà di tipi di cellule immunitarie attratte al sito tumorale e cellule che formano i vasi sanguigni, che portano nutrienti al tumore.
La squadra di Tuveson ha sviluppato una nuova tecnologia in collaborazione con gli scienziati Sylvia Fernandez-Boj e Hans Clevers diversi anni fa per crescere colture di tumori pancreatici – campionati da pazienti e topi – che si sviluppano in un 3 dimensioni. Chiamati organoidi pancreatici, queste piccole sfere imitano la biologia dei campioni di tumore da cui derivano e quindi sono un valido aiuto per i ricercatori che cercano di saperne di più sulla biologia del tumore e per la sperimentazione di nuove combinazioni di trattamenti.
Negli esperimenti riportati oggi, la tecnologia organoide è stata portata ad un nuovo livello, in cui gli organoidi derivati da tumori sono per la prima volta in “co-coltura” con un componente dello stroma in cui i tumori reali crescono. Il risultato è una resa più realistica di ciò che accade nel pancreas dei malati di cancro.
Il fattore aggiunto alla coltura organoide era un tipo di cellula chiamata CAF – fibroblasti cancro-associati-, che era stata in precedenza bersaglio dei ricercatori per indirizzare terapeuticamente lo stroma in PDA.
“Le cellule CAF sono come fabbriche di tessuto connettivo nel tumore”, dice il Dr. Öhlund. In passato, gli scienziati hanno ipotizzato che il tessuto connettivo aiuta le cellule tumorali a svilupparsi e proliferare.
I fibroblasti fanno parte dello stroma e sono tipicamente non-cancerosi, ma contribuiscono allo sviluppo del cancro secernendo, tra gli altri fattori, molecole di struttura che trasmettono allo stroma. Ma questa è solo una delle loro funzioni. Gli esperimenti condotti da Öhlund hanno scoperto qualcosa che precedentemente non era conosciuta: i fibroblasti si presentano nell’adenocarcinoma del dotto pancreatico in almeno due varietà e forse più.
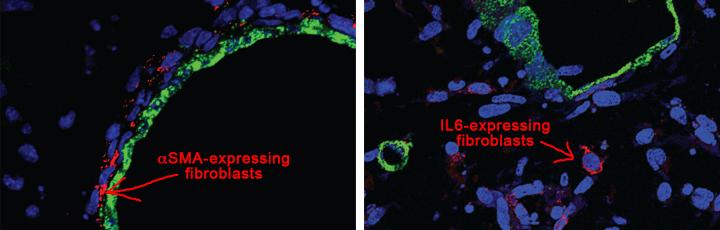
Questa scoperta di eterogeneità nella porzione di fibroblasti dello stroma nel cancro del pancreas apre il campo ad una serie di nuove possibilità. Un sottotipo di fibroblasti notato dal team di Tuveson si distingueva per la sua produzione di alti livelli di una proteina chiamata alfa actina del muscolo liscio o αSMA. Öhlund ha scoperto che i fibroblasti che producono αSMA erano immediatamente adiacenti alle cellule tumorali neoplastiche nel tessuto tumorale umano e di topo. Questo risultato è stato successivamente osservato negli organoidi PDA coltivati in co-culture con i fibroblasti. Inoltre, il team ha notato che questa co-coltura ha portato alla formazione di uno stroma desmoplastico, materiale denso che ostacola il trattamento dei pazienti con cancro del pancreas.
Handly-Santana ha scoperto che un secondo sottotipo di fibroblasti si era distinto da altri per la produzione e la secrezione del fattore di modulazione della risposta immunitaria Interleuchina 6 (IL-6). In contrasto con i fibroblasti che esprimono αSMA, i fibroblasti secernenti IL-6 sono risultati più distanti dalle cellule tumorali nei tumori PDA umani e di topo e negli organoide in co-culture e non esprimono quantità elevate di αSMA.
IL-6 è collegato alla proliferazione delle cellule tumorali e al processo di cachessia, una sindrome di atrofia muscolare che provoca debolezza e la soppressione immunitaria in molti pazienti affetti da cancro del pancreas.
“I nostri risultati sottolineano che lo stroma è piuttosto eterogeneo in PDA”, dice Tuveson, “e questo, a sua volta, ci offre l’opportunità di sviluppare agenti terapeutici che hanno come target specifiche sottopopolazioni di fibroblasti. C’è molto lavoro da fare ancora per quanto riguarda la conoscenza dei fattori che sono responsabili di questo comportamento, ma siamo sulle tracce di questi meccanismi”, ha aggiunto Giulia Biffi.
“La visione tradizionale dello stroma tumorale come una nicchia uniformemente pro-oncogena ha bisogno di essere riconsiderata alla luce della scoperta che alcuni sottotipi di fibroblasti potrebbero avere proprietà pro-tumorali, mentre altri potrebbero avere proprietà anti-tumorali. Lo sviluppo di nuove terapie deve prendere in considerazione questa possibilità”, ha riassunto Tuveson.
Fonte: Journal of Experimental Medicine