Gli scienziati hanno scoperto un modo per mettere a punto un percorso centrale di controllo dei grassi nel fegato, riducendo i trigliceridi dannosi nel sangue e preservando al contempo le funzioni benefiche del colesterolo.
Quando mangiamo, il corpo trasforma le calorie in eccesso in molecole chiamate “trigliceridi”, soprattutto quando queste calorie provengono da carboidrati, zuccheri, grassi e alcol. I trigliceridi sono un tipo di grasso o “lipide” e il corpo li immagazzina nelle cellule adipose per utilizzarli come carburante tra un pasto e l’altro.
Tuttavia, un eccesso di questi grassi può essere dannoso. Livelli elevati di trigliceridi possono portare a “ipertrigliceridemia” (eccesso di trigliceridi nel sangue), una condizione legata a un rischio molto più elevato di malattie cardiache, ictus e pancreatite. Ecco perché si incoraggiano ampiamente le persone a mantenere livelli sani di trigliceridi attraverso la dieta e l’esercizio fisico, mentre i casi più gravi potrebbero richiedere farmaci.
Riduzione del volume di un recettore
Livelli sani di grassi nel sangue si basano su un equilibrio tra la quantità di grasso che entra in circolo e la velocità con cui viene eliminato. Il fegato e l’intestino inviano particelle di grasso nel flusso sanguigno e gli enzimi aiutano a scomporle in modo che l’organismo possa eliminarle. Se l’organismo produce più grassi di quanti ne possa elaborare, i trigliceridi si accumulano e possono contribuire a disturbi come dislipidemia, pancreatite acuta e steatosi epatica associata a disfunzione metabolica (MASLD).
Un regolatore chiave di questa rete è il recettore X del fegato o LXR, una proteina che controlla numerosi geni coinvolti nel modo in cui l’organismo produce e gestisce i grassi.
Quando l’attività di LXR aumenta, spesso aumentano anche i livelli di trigliceridi e colesterolo. Ridurre la segnalazione di LXR con un farmaco potrebbe essere utile, ma c’è un problema. Poiché LXR supporta anche percorsi protettivi correlati al colesterolo in altri tessuti, bloccarlo in tutto il corpo potrebbe creare effetti indesiderati. Questo compromesso ha reso difficile trasformare LXR in un bersaglio terapeutico sicuro.
Un farmaco che agisce specificamente sul fegato LXR
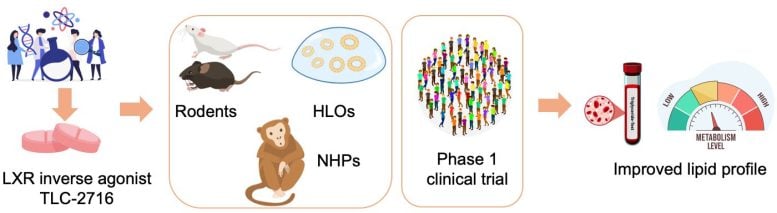
I ricercatori guidati da Johan Auwerx dell’EPFL e Mani Subramanian di OrsoBio hanno ora sviluppato un composto somministrabile per via orale, progettato per limitare l’attività del recettore LXR principalmente nel fegato e nell’intestino. L’obiettivo è ridurre i trigliceridi mantenendo intatte le vie protettive del colesterolo nell’organismo.
Il farmaco, TLC-2716, è descritto come un “agonista inverso” per LXR. A differenza di un “bloccante” (“antagonista”) che si limita a prevenirne l’attivazione, un “agonista inverso” spinge il recettore verso la direzione opposta a quella del suo normale meccanismo di segnalazione.
Il lavoro, pubblicato su Nature Medicine, è il primo studio di questo approccio ad essere testato sugli esseri umani.
Combinazione di set di dati genetici per trovare la variante recettoriale giusta
Gli scienziati hanno iniziato analizzando ampi set di dati genetici umani per determinare quale variante di LXR sia correlata ai biomarcatori di trigliceridi elevati nel sangue. I dati hanno indicato le varianti genetiche all’interno di LXRα, che è altamente espresso nel fegato.
Ciò è stato ulteriormente confermato dalla “randomizzazione mendeliana”, un potente metodo che determina relazioni causali tra espressione genica ed esiti. In questo caso, ha confermato un nesso causale tra LXRα e disturbi metabolici: una maggiore espressione di LXRα può far aumentare i trigliceridi.
I risultati hanno contribuito a selezionare TLC‑2716 come composto efficace da testare contro LXRα.
Test del composto
Lo studio si è poi spostato dai computer al laboratorio. Nei modelli di roditori affetti da malattie metaboliche, TLC-2716 e un composto correlato hanno abbassato i trigliceridi e il colesterolo nel sangue e ridotto l’accumulo di grassi nel fegato. Nel frattempo, esperimenti su organoidi epatici umani (modelli in miniatura di tessuto epatico malato, coltivati in laboratorio), hanno mostrato la stessa tendenza, con un minore accumulo di lipidi e una minore infiammazione e fibrosi.
La sperimentazione clinica
I risultati di laboratorio hanno posto le basi per uno studio di Fase 1 randomizzato, controllato con placebo, condotto su adulti sani. I partecipanti hanno ricevuto TLC-2716 per 14 giorni, somministrato in una singola dose giornaliera e lo studio si è concentrato inizialmente sulla sicurezza e sulla tollerabilità; gli autori riferiscono che il farmaco ha raggiunto questi endpoint primari.
Ma anche questo breve studio ha avuto effetti evidenti: i partecipanti che hanno ricevuto dosi più elevate di TLC-2716 hanno mostrato notevoli cali dei trigliceridi e del colesterolo residuo. Alle dosi più elevate di TLC-2716 (12 mg), i trigliceridi sono diminuiti fino al 38,5%, mentre il colesterolo residuo postprandiale (“dopo i pasti”) è diminuito fino al 61%. Questo è avvenuto nonostante i partecipanti partissero da livelli lipidici relativamente normali e senza l’uso di altri farmaci ipolipemizzanti.
Leggi anche: Alti livelli di trigliceridi causano aneurismi aortici potenzialmente letali
Il trattamento ha anche accelerato la clearance dei trigliceridi riducendo l’attività di due proteine che normalmente la rallentano, ApoC3 e ANGPTL3. Allo stesso tempo, lo studio non ha rilevato riduzioni nell’espressione nelle cellule del sangue di ABCA1 e ABCG1, geni utilizzati qui come marcatori associati al trasporto inverso del colesterolo.
I risultati dello studio dimostrano che la riduzione selettiva dell’attività di LXR nel fegato e nell’intestino mediante TLC-2716 può offrire una nuova via, complementare ad altri approcci, per contrastare l’ipertrigliceridemia e i disturbi metabolici correlati. I dati di Fase 1 supportano ulteriori test clinici in studi di Fase 2, anche su persone con ipertrigliceridemia e MASLD. Saranno necessari studi più ampi, ma, per ora, la ricerca ha la sua prima prova di principio sull’uomo.
Fonte: Nature Medicine