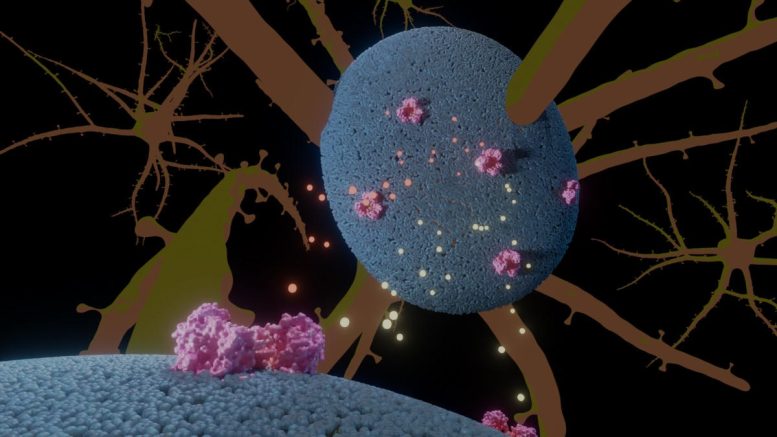
Illustrazione del trasportatore del glutammato (rosa) nelle cellule neurali (blu), con glutammato e anioni in giallo e arancione. Credito: A. Guskov, Università di Groningen
L’atassia episodica di tipo 6 è una rara malattia neurologica che colpisce solo un piccolo numero di individui a livello globale. Porta a una temporanea perdita di coordinazione muscolare ed è causata da una mutazione che altera un singolo amminoacido in una proteina responsabile del trasporto del neurotrasmettitore glutammato attraverso le membrane delle cellule neurali. Scienziati dell’Università di Groningen nei Paesi Bassi hanno scoperto il meccanismo attraverso il quale questa mutazione causa il malfunzionamento di queste cellule. Le loro scoperte sono state recentemente pubblicate sulla rivista Nature Communications.
Gli individui che soffrono di atassia sperimentano una perdita di controllo muscolare, che può provocare difficoltà con i movimenti e la parola. Tra le varie forme di atassia, l’atassia episodica di tipo 6 (EA6) è una condizione particolarmente rara, caratterizzata da episodi di perdita del controllo muscolare. Attualmente, solo un piccolo numero di individui, inclusa una famiglia nei Paesi Bassi, è stato identificato come affetto da EA6 in tutto il mondo, con il numero totale di pazienti noti che ammonta a poco più di una dozzina.
È noto che l’EA6 è causata da una singola mutazione, ma come questa mutazione possa avere un effetto così devastante era finora un mistero. “Questa proteina trasporta il glutammato attraverso la membrana delle cellule neurali,” spiega il biologo strutturale Albert Guskov. La proteina viene inserita nella membrana cellulare e la mutazione trasforma un amminoacido prolina in uno dei domini elicoidali transmembrana in un’arginina.
Sorpresa
“Una prolina in un’elica in genere provoca un nodo”, spiega Guskov. “Se una prolina viene trasformata in arginina, ci aspetteremmo che questo nodo scompaia. Per verificarlo, abbiamo studiato la struttura della proteina mutata”.
Poiché la proteina di trasporto umana è difficile da studiare in laboratorio, Guskov e i suoi colleghi hanno utilizzato una proteina analoga dell’archaea, un’antica forma di organismo unicellulare.
“Questa proteina arcaica è stata ben conservata durante l’evoluzione e sappiamo da lavori precedenti che è un buon modello per la proteina di trasporto umano, anche se trasporta aspartato e non glutammato“, spiega Guskov.
Utilizzando la microscopia crioelettronica su proteine normali e mutate collocate in nanodischi lipidici, il team è stato in grado di confrontare la forma della proteina mutata con la versione normale. In studi precedenti, il team aveva dimostrato che parte della proteina si muove su e giù attraverso la membrana, proprio come un ascensore. L’ipotesi era che la mutazione avrebbe causato la scomparsa del nodo transmembrana nella proteina e che questo avrebbe cambiato la forma della proteina e bloccato il movimento dell’elevatore.
Tuttavia, non era così. Guskov dice: “Con nostra sorpresa, il nodo era ancora lì”.
Tuttavia, la mutazione ha influenzato il funzionamento della proteina. “Il tasso di trasporto è stato ridotto di un fattore due, rispetto alla normale proteina“. Inoltre, durante il trasporto dell’aspartato, la proteina formava transitoriamente un canale anionico. “E nella proteina mutata, il trasporto di ioni era tre volte superiore”.
Brutte conseguenze
In qualche modo, l’arginina che ha sostituito la prolina non ha alterato la forma della proteina di trasporto, ma ne ha influenzato la funzione. Pertanto, i ricercatori hanno eseguito simulazioni di dinamica molecolare, che mostrano tutte le interazioni degli amminoacidi della proteina con l’ambiente circostante. “Quello che abbiamo notato è che si forma un ponte salino tra l’amminoacido arginina e i lipidi della membrana”. Questo ponte salino, una forma di attrazione tra le molecole, sembra rallentare il movimento della parte elevata della proteina.
Guskov spiega: “Se questo elevatore si muove più lentamente, ciò spiega la diminuzione del trasporto dell’aspartato, ma significa anche che il canale ionico transitorio rimane aperto più a lungo, consentendo così il passaggio di più anioni”. Nelle cellule neurali umane, ciò porterebbe a un trasporto ridotto del neurotrasmettitore glutammato e a un aumento dello squilibrio anionico. Questi risultati spiegano come questa mutazione causi l’atassia. “Entrambi hanno conseguenze molto brutte per il funzionamento delle cellule neurali”.
Vedi anche:La scoperta dei geni essenziali per la vita aiuta la ricerca sulle malattie rare
Tuttavia, non esiste un modo semplice per rimediare all’effetto della mutazione. “Inoltre, questo trasportatore è presente in tutto il corpo, quindi qualsiasi farmaco che lo influenza avrà probabilmente gravi effetti collaterali“. Inoltre, poiché ci sono solo pochi pazienti, nessuna azienda farmaceutica investirebbe in una cura. “Poiché si tratta di una malattia episodica e i sintomi possono essere lievi, molte persone potrebbero non esserne consapevoli. Sono semplicemente abituati a stare male per pochi giorni alla volta, proprio come chi soffre di emicrania“.
Per la comunità scientifica, questi risultati sollevano una serie di domande intriganti. Guskov dice: “La proteina è stata molto ben conservata nel corso della storia evolutiva. Allora perché è apparso questo canale anionico transitorio e si è rivelato così benefico per l’archaea da essere trasportato nel tempo fino ai nostri stessi neuroni? Questo è quello che vorremmo capire”.
Fonte:Nature Commuinications