L’Alzheimer è una malattia non curabile, caratterizzata da aggregazioni della proteina beta-amiloide e della proteina tau nel cervello, ma il rapporto diretto tra queste proteine e la neurodegenerazione è rimasto un mistero. Una nuova ricerca di imaging molecolare ha rivelato che i depositi di proteina Tau, piuttosto che di beta-amiloide, possono essere responsabili della disfunzione neuronale.
La ricerca è stata presentata all’ Annual Meeting of the Society of Nuclear Medicine and Molecular Imaging (SNMMI) 2016.
Questa esaustiva ricerca sul cervello ha evidenziato come le placche extracellulare beta-amiloidi e grovigli neurofibrillari intracellulari di proteine tau sono fortemente collegati alla patologia neurodegenerativa della malattia di Alzheimer. Tuttavia, gran parte della ricerca condotta fino ad oggi è stata realizzata su campioni post-mortem, che poco hanno aiutato i ricercatori a capire lo sviluppo precoce della malattia.
( Vedi anche:Alzheimer: scoperto l’anello mancante tra la proteina Tau e perdita di memoria).
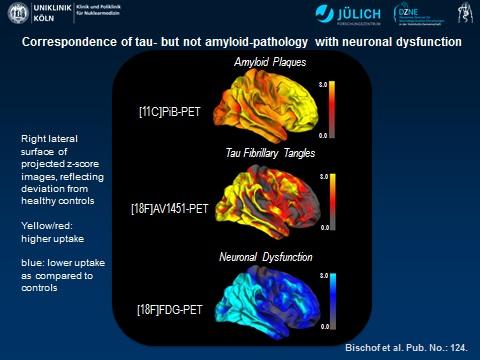
Un nuovo studio di imaging su pazienti di Alzheimer, ha combinato tre metodi di tomografia ad emissione di positroni (PET) per misurare l’attività delle beta amiloide, tau e l’attività metabolica del cervello. I risultati dello studio hanno dimostrato una correlazione significativa tra aumento della proteina tau e ridotta attività metabolica del cervello, un chiaro segno di neurodegenerazione.
“La proteina Tau sembra essere strettamente collegata alla effettiva insorgenza del danno neuronale, mentre le proteine beta amiloidi possono indicare una predisposizione alla malattia molti anni prima della comparsa dei sintomi”, ha spiegato Alexander Drzezga, MD, dal Centro tedesco per la Malattie neurodegenerative presso l’Ospedale Universitario di Colonia.
I risultati dello studio hanno dimostrato che l’aumento della proteina tau è direttamente connesso all’ ipometabolismo (che riflette una disfunzione neuronale) nel cervello, mentre per i depositi di beta amiloide non è stata trovata alcuna forte associazione con l’ ipometabolismo. Tuttavia, un’interattività indiretta tra tau e amiloide è stata osservata soprattutto nella corteccia parietale, in quanto l’impatto negativo dei depositi Tau sul metabolismo è maggiore nelle regioni del cervello con maggiore deposito di beta amiloide.
“L’integrazione di questi strumenti di imaging molecolare offre l’opportunità di indagare il possibile contributo indipendente e sinergico di queste proteine alla neurodegenerazione nel cervello vivente e, di conseguenza, avanza notevolmente la nostra comprensione dei meccanismi alla base della malattia di Alzheimer”, ha detto Drzezga.
Ulteriori indagini di questi e altri fattori di neurodegenerazione in pazienti affetti da demenza potrebbero un giorno aiutare i medici a migliorare l’accuratezza diagnostica e portare a nuove terapie per il morbo di Alzheimer, incluso lo sviluppo di nuovi farmaci che potrebbero potenzialmente avere come obiettivo la proteina tau al fine di rallentare o fermare i suoi effetti degenerativi nel cervello. L’imaging multimodale si avvicina ad una più precisa visualizzazione dello sviluppo della neuropatologia, rilevabile anche prima della comparsa irrevocabile della perdita di memoria vissuta dai malati di Alzheimer. Inoltre, il miglioramento della previsione, prognosi e terapia, follow-up di controllo, possono diventare realtà.
Più di 46 milioni di persone vivono attualmente con il morbo di Alzheimer in tutto il mondo e questo numero è destinato ad aumentare vertiginosamente a 131,5 milioni entro il 2050. Il costo economico globale della malattia è previsto per avvicinarsi ad un trilione di dollari nello stesso periodo, secondo i più recenti dati dell’Alzheimer Disease International.
Fonte: EurekAlert