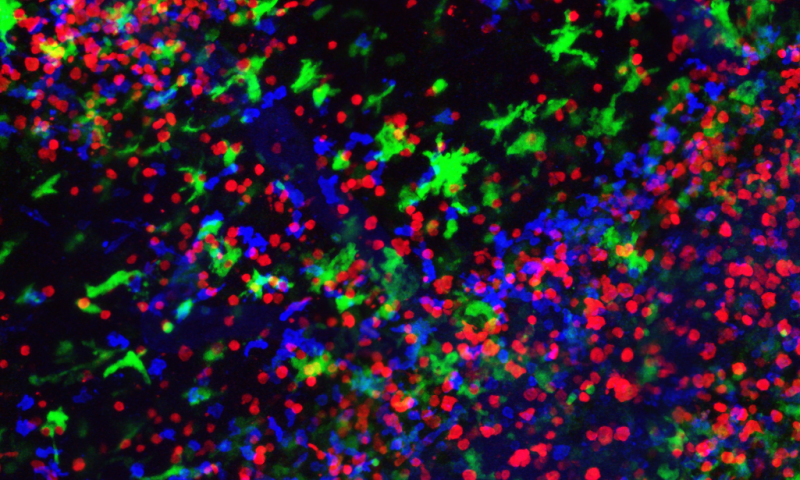
Immagine: le cellule mieloidi (in verde) esacerbano la gravità della sclerosi multipla con l’invio di segnali chimici che stimolano l’infiammazione e attraggono le cellule T autoimmuni (indicaei in rosso) verso il sistema nervoso centrale. Credit: Dr. Iftach Shaked, La Jolla Institute for Allergy and Immunology
La sclerosi multipla, una malattia neurologica debilitante, è innescata dalle cellule T autoreattive che si infiltrano con successo nel cervello e midollo spinale dove lanciano un attacco autoimmune aggressivo contro la mielina, la sostanza grassa che circonda e isola le fibre nervose. Nel corso del tempo, i periodi conseguenti l’ infiammazione danneggiano in modo permanente la guaina mielinica e le fibre nervose che protegge, interrompendo i segnali nervosi che viaggiano ‘da e verso’ il cervello.
“I nostri risultati dimostrano che i macrofagi e monociti partecipano attivamente all’inizio e alla progressione della sclerosi multipla che è stata a lungo considerata una malattia principalmente guidata dalle cellule T”, dice l’autore senior dello studio Catherine Hedrick, Ph. , ricercatrice della Division of Inflammation Biology.”Essi aggravano la gravità della malattia inviando segnali chimici che stimolano l’infiammazione e attirano cellule T autoimmuni verso il sistema nervoso centrale”.
Rivelando i meccanismi molecolari che controllano la neuroinfiammazione, questi risultati aggiungono un nuovo livello di complessità alla nostra comprensione della sclerosi multipla e sostengono il crescente apprezzamento del significato del crosstalk tra il sistema immunitario periferico e il cervello. Essi inoltre, aprono nuove strade per potenziali terapie per la sclerosi multipla attraverso la manipolazione dei livelli di regolatori del sistema immunitario che contribuiscono all’ infiammazione del sistema nervoso centrale.
“La sclerosi multipla colpisce milioni di persone in tutto il mondo”, dice l’autore dello studio Iftach Shaked, Ph.D., un ricercatore post-dottorato. “Ma ciò che è veramente sconcertante è che tutti noi abbiamo cellule T autoimmuni che riconoscono la proteina basica della mielina, ma di solito non si infiltrano nel sistema nervoso centrale e non causano la malattia”.
Lo stress può peggiorare i sintomi delle malattie infiammatorie come la sclerosi multipla, ma i meccanismi molecolari che legano stress cellulare e neuroinfiammazione sono ancora poco chiari.
Un incontro casuale tra Shaked e il co-primo autore Richard Hanna, Ph.D., un immunologo nel laboratorio di Hedrick, ha portato ad una collaborazione che ha fornito un punto di partenza importante. Hanna ha studiato una proteina nota come NR4A1, che risponde a segnali sia infiammatori che di stress e insieme ai ricercatori ha ipotizzato che può essere un fattore chiave nella prevenzione dell’autoimmunità che colpisce il sistema nervoso centrale.
Per affrontare l’importanza di NR4A1 nell’ autoimmunità nel cervello, i ricercatori hanno indotto encefalomielite autoimmune (EAE), un modello di sclerosi multipla, in topi con e senza NR4A1. In assenza di NR4A1, le cellule T autoreattive si sono infiltrate nel sistema nervoso centrale molto prima e in numero maggiore esacerbando la progressione e la gravità della malattia, rispetto al gruppo di controllo.
Quando Shaked e Hanna hanno scavato più a fondo, hanno scoperto che NR4A1 reprime la produzione di noradrenalina, un importante mediatore della risposta del corpo a fattori di stress fisiologici e psicologici. Senza NR4A1 che funge da ammortizzatore, monociti e macrofagi aumentano la secrezione di noradrenalina che a sua volta porta all’attivazione dei macrofagi, amplificando così la neuroinfiammazione e causando un massiccio afflusso di cellule T nel sistema nervoso centrale.
“Le cellule mieloidi, tra cui i macrofagi, hanno recettori per le molecole di segnalazione dello stress, che permettono loro di rispondere ai segnali del sistema nervoso simpatico”, spiega Hanna.
NR4A1 regola la produzione di noradrenalina limitando la quantità di tirosina idrossilasi, l’enzima che controlla la biosintesi della noradrenalina. Quando NR4A1 manca, la tirosina idrossilasi è altamente espressa nei monociti e macrofagi che peggiorano la sclerosi multipla. Al contrario, l’eliminazione di tirosina idrossilasi dalle cellule mieloidi, protegge i topi dalla malattia.
Un piccolo studio pilota ha indicato che gli stessi canali di comunicazione potrebbero essere utilizzati per inviare messaggi tra il cervello e il sistema immunitario periferico nei pazienti con sclerosi multipla.” I monociti e i macrofagi hanno un modo per amplificare l’infiammazione del sistema nervoso centrale”, dice Shaked “, che dimostra davvero che le cellule mieloidi hanno un ruolo inaspettato e importante nelle malattie del cervello”.
Fonte: The Innate Immune System Modulates the Severity of Multiple Sclerosis