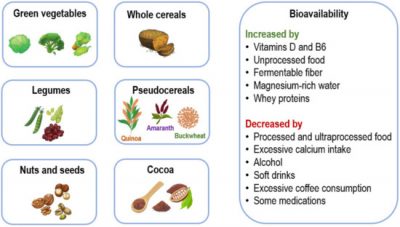
Magnesio-immagine: principali fonti alimentari di magnesio e fattori che ne aumentano o diminuiscono la biodisponibilità. Credito Nutrients
Il magnesio è uno ione essenziale per l’organismo umano, che regola numerosi processi fisiologici e patologici. La carenza di magnesio è molto comune in età avanzata. Le malattie croniche legate all’età e il processo di invecchiamento stesso sono spesso associati a un’infiammazione cronica di basso grado, chiamata “inflammaging”.
“Poiché l’insufficienza cronica di magnesio è stata collegata a un’eccessiva produzione di marcatori infiammatori e radicali liberi, inducendo uno stato infiammatorio cronico, abbiamo precedentemente ipotizzato che la carenza di magnesio potesse essere considerata tra gli intermediari che ci aiutano a spiegare il legame tra inflammaging e malattie associate all’invecchiamento. In questa revisione mostriamo le prove della relazione tra magnesio e tutti i tratti distintivi dell’invecchiamento (instabilità genomica, logoramento dei telomeri, alterazioni epigenetiche, perdita di proteostasi, alterazione del rilevamento dei nutrienti, disfunzione mitocondriale, senescenza cellulare, esaurimento delle cellule staminali, alterazione della comunicazione intercellulare, autofagia disfunzionale, disbiosi e infiammazione cronica), che possono influire positivamente sulla salute umana. È possibile ipotizzare che mantenere un equilibrio ottimale di magnesio durante il corso della vita possa rivelarsi una strategia sicura ed economica che contribuisce a promuovere un invecchiamento sano. Sono necessari futuri studi ben progettati per approfondire questa ipotesi”, spiegano gli autori.
Collegamenti del magnesio con i segni distintivi dell’invecchiamento
Ai nove tratti distintivi dell’invecchiamento originariamente proposti nel 2013, ne sono stati aggiunti altri, tra cui l’autofagia disabilitata, il disturbo del microbioma e l’infiammazione. Ognuno di questi tratti distintivi soddisfa i seguenti criteri: (1) si verifica durante il normale invecchiamento; (2) la sua esacerbazione sperimentale accelera l’invecchiamento; e (3) il suo miglioramento sperimentale rallenta l’invecchiamento e, di conseguenza, aumenta la durata della vita. La traiettoria dell’invecchiamento è flessibile e può essere modulata da fattori dietetici, incluso il magnesio, e altri determinanti dello stile di vita. Il magnesio è coinvolto in diversi processi cellulari ( Figura 4 ).
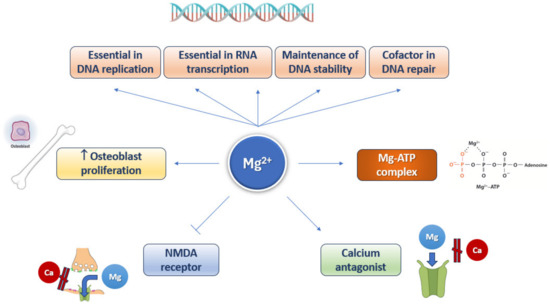
Figura 4. Coinvolgimento del magnesio in diversi processi cellulari.
Nelle prossime sottosezioni ci concentreremo sui vari tratti distintivi dell’invecchiamento, che sono stati strettamente correlati al magnesio ( Figura 5 ).
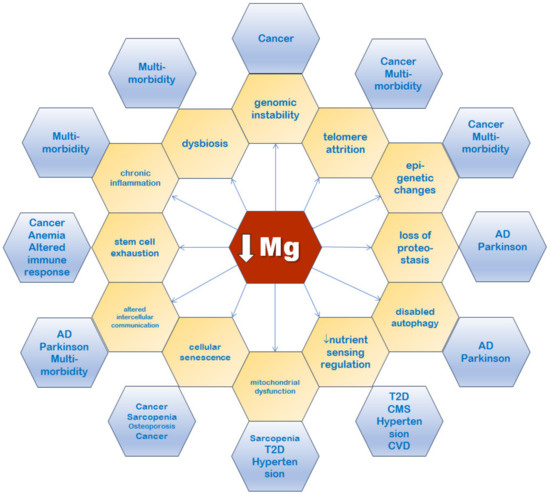
Figura 5. Un basso livello di magnesio è associato a tutti i segni distintivi dell’invecchiamento (giallo). Esempi di malattie legate all’età associate ai segni distintivi dell’invecchiamento sono mostrati in blu. AD: morbo di Alzheimer; CMS: sindrome cardiometabolica; CVD: malattia cardiovascolare; e T2D: diabete di tipo 2.
5.1. Instabilità genomica
L’instabilità genomica si riferisce a una maggiore predisposizione alle modifiche genomiche (ad esempio, danni al DNA, mutazioni e anomalie cromosomiche) ed è generata dagli effetti delle alterazioni epigenetiche, dello stress ossidativo e della carente riparazione del DNA e manutenzione dei telomeri. Il DNA codifica una serie di processi che rilevano e riparano praticamente tutte queste forme di danno; tuttavia, i meccanismi di riparazione del DNA diventano meno efficaci durante l’invecchiamento, favorendo l’accumulo di mutazioni geniche, che vengono trasferite in ogni futura copia di una cellula. Il cancro è uno dei risultati del danno al DNA non riparato o della riparazione errata. Le mutazioni del DNA si verificano per tutta la vita; più lunga è la durata della vita, maggiore è la probabilità che si verifichino. L’instabilità genomica è probabilmente uno dei principali fattori dell’invecchiamento che in definitiva influenza la produzione di proteine funzionali essenziali necessarie per le reazioni cellulari biochimiche, la comunicazione cellula-cellula e il mantenimento dell’impalcatura.
Sia i solchi minori che quelli maggiori del DNA hanno siti di legame specifici per il magnesio. Quasi cinquant’anni fa, è stato dimostrato che il magnesio è essenziale per la fedeltà della replicazione del DNA nella DNA polimerasi. Il magnesio contribuisce a stabilizzare l’assemblaggio della cromatina durante tutto il ciclo cellulare, è coinvolto nella struttura secondaria e terziaria del DNA e stabilizza la conformazione del DNA tramite legami idrogeno o forza elettrostatica. Pertanto, mantenere il magnesio intracellulare a un livello fisiologico è un importante determinante della stabilità del DNA. Al contrario, concentrazioni inadeguate di magnesio indeboliscono la stabilità del DNA inducendo danni e stress ossidativo alla struttura a doppio filamento. Il magnesio è necessario per l’attivazione di vari enzimi coinvolti nei percorsi di riparazione del DNA, come la riparazione per escissione di basi, la riparazione per escissione di nucleotidi e la riparazione degli errori di corrispondenza, dimostrando il suo ruolo cruciale nel preservare la stabilità del genoma.
5.2. Attrito dei telomeri
I telomeri sono sezioni di sequenze nucleotidiche ripetitive (TTAGGG negli esseri umani) contenenti informazioni non essenziali, situate ad entrambe le estremità di ciascun cromosoma e che proteggono dalla sua degradazione e fusione con altri cromosomi. Ciò garantisce che nessuna informazione genetica venga persa e controlla il numero di replicazioni cellulari. Una piccola frazione di DNA telomerico (50-100 coppie di basi nei fibroblasti umani) viene persa in ogni divisione cellulare a causa del problema della replicazione finale, che rende i telomeri gradualmente più corti con l’avanzare dell’età. Quando i telomeri raggiungono una lunghezza criticamente breve, le cellule lo riconoscono e disattivano il loro meccanismo di replicazione, diventando senescenti, cosa che si verifica dopo circa 50 divisioni nella maggior parte delle cellule umane. Questo limite aiuta a prevenire il cancro (limita la capacità proliferativa cellulare) rispetto alla replicazione incontrollata delle cellule tumorali. La telomerasi, che è disattivata nella maggior parte delle cellule adulte, può prevenire l’accorciamento dei telomeri e persino ripristinarne la lunghezza. I telomeri possono accorciarsi a causa dello stress ossidativo e telomeri più corti sono stati associati a un aumento del rischio di cancro, malattie cardiovascolari e mortalità, in particolare in età più giovane.
Il magnesio influenza la struttura e l’integrità della cromatina telomerica. Oltre il cinquanta percento dei telomeri si trova nelle lamine nucleari e le loro proteine leganti la laminina dipendono dalle concentrazioni di magnesio. Il magnesio è anche coinvolto nella regolazione della telomerasi. Il componente catalitico della telomerasi è la trascrittasi inversa della telomerasi (TERT); la TERT esercita i suoi effetti biologici attraverso l’interazione con il pathway del bersaglio della rapamicina nei mammiferi (mTOR), che è modulato dalla concentrazione di magnesio. Il magnesio protegge dal declino del potenziale rigenerativo muscolare correlato all’età e dalla perdita di massa muscolare attivando la segnalazione mTOR. Inoltre, le fluttuazioni circadiane di mTOR sono regolate dalle oscillazioni del magnesio in modo sensibile all’MgATP. L’espressione del messaggero (m)RNA TERT è modificata da ritmi circadiani alterati che accelerano il processo di invecchiamento, mentre le fluttuazioni del magnesio modulano l’orologio cellulare.
5.3. Alterazioni epigenetiche
L’epigenetica si riferisce alle modifiche dell’espressione del genoma senza alterare la sequenza del DNA che modulano le funzioni cellulari e tissutali. Ogni cellula contiene la stessa sequenza di DNA, ma l’aggiunta di marcatori epigenetici attiva e disattiva l’espressione di determinati geni a seconda della situazione. L’epigenoma può essere modificato dalla dieta, da altri fattori legati allo stile di vita e dai farmaci. Il complesso meccanismo epigenetico comprende diverse molecole e marcatori, tra cui la metilazione del DNA, la scrittura e la cancellazione di questi marcatori, le modificazioni degli istoni e le proteine e gli enzimi che consentono la lettura dei marcatori. Include anche modelli di espressione di RNA non codificante (ncRNA) con dimensioni che vanno dal microRNA (~22 nucleotidi) al lungo ncRNA (>200 nucleotidi). Diverse malattie e l’invecchiamento stesso sono associati a modelli aberranti di marcatori e molecole epigenetiche. La cromatina compatta solitamente presente nelle cellule di individui giovani e sani accumula danni da molteplici insulti nel tempo con l’invecchiamento, compromettendo infine l’integrità genomica e il funzionamento cellulare. Poiché le cellule sono esposte a fattori ambientali per un lungo periodo di tempo, le modifiche epigenetiche possono essere perse, aggiunte in modo inappropriato o spostate. L’ambiente infiammatorio correlato all’età con varie molecole inibitorie rilasciate da cellule danneggiate e stressate porta all’accumulo di alterazioni epigenetiche, modificando in definitiva la funzione cellulare.
Il magnesio è stato collegato all’epigenetica. Takaya et al. hanno scoperto che, nella prole di ratti gravidi con carenza di magnesio, i promotori epatici dell’11β-idrossisteroide deidrogenasi-2 (Hsd11b2) mostravano un’ampia ipermetilazione, contribuendo alla down-regulation dell’espressione genica. In questo studio, una dieta a basso contenuto di magnesio ha indotto la metilazione di specifiche citosine nei geni dei glucocorticoidi epatici, generando alterazioni metaboliche nella prole neonatale.
5.4. Disfunzione mitocondriale
I mitocondri sono la “centrale energetica” cellulare che produce la maggior parte dell’ATP disponibile, che è la principale fonte di energia per i processi cellulari. Hanno un proprio genoma, che è suscettibile al danno, essendo immagazzinato in una posizione pro-ossidativa. I mitocondri sono il nucleo di molteplici cascate di segnalazione che guidano il destino cellulare verso la sopravvivenza o la morte per apoptosi. Sono le principali fonti di radicali liberi (specie reattive dell’ossigeno, ROS) come conseguenza del normale metabolismo cellulare e della respirazione aerobica, che, quando superano la capacità antiossidante cellulare, sono stati collegati all’invecchiamento e a varie malattie associate all’età, tra cui l’Alzheimer e il morbo di Parkinson, tra gli altri. Infatti, l‘accumulo di mitocondri disfunzionali è caratteristico dell’invecchiamento, con una diminuzione della produzione di ATP e un aumento della generazione di ROS. Un eccesso di ROS danneggia tutte le molecole, dalle proteine al DNA, causandone la mutazione e, di conseguenza, la disregolazione della loro funzione. I mitocondri disfunzionali producono meno ATP, riducendo l’apporto energetico e portando, nel tempo, a infiammazione cronica, stress ossidativo e danno cellulare.
Tra le numerose funzioni cellulari del magnesio, la più importante è probabilmente il suo legame all’ATP nel complesso Mg-ATP. Oltre un terzo del magnesio cellulare si trova nei mitocondri, ed è concentrato soprattutto tramite lo splicing 2 dell’RNA mitocondriale (Mrs2), che forma un canale proteico di ingresso del magnesio ed è espresso nella membrana mitocondriale interna.
Valori tendenzialmente bassi di magnesio, anche quelli definiti normali dal laboratorio, dovrebbero essere considerati inadeguati. È inoltre necessario considerare la politerapia; quindi, si dovrebbe raccomandare in primo luogo un’assunzione adeguata di alimenti ricchi di magnesio, prendendo in considerazione l’integrazione solo per le persone che non possono seguire tale dieta. È importante considerare che l’integrazione di magnesio può causare diarrea se somministrata in dosi elevate; pertanto, è necessaria un’adeguata titolazione della dose. Inoltre, è importante valutare la funzionalità renale prima dell’integrazione, mentre l’integrazione di magnesio nei pazienti con insufficienza renale deve essere intrapresa con cautela.
Negli ultimi decenni si sono registrati progressi significativi nella ricerca sull’invecchiamento, ma è comprensibile che manchi ancora una teoria unificata dell’invecchiamento in grado di spiegare appieno un processo così complesso. Lo studio dei tratti distintivi dell’invecchiamento come eventi isolati può aiutare i ricercatori a definire meglio i meccanismi alla base del complesso processo di invecchiamento. Tuttavia, questi meccanismi possono interagire tra loro.
La possibilità che mantenere un adeguato equilibrio di magnesio nel corso della vita possa diventare una strategia economica e sicura che contribuisce a un invecchiamento sano è un’ipotesi intrigante, che deve essere ulteriormente esplorata da futuri studi ben progettati.
Autori dello studio sono: Ligia J. Dominguez, Mario Barbagallo e Nicola Veronese, rispettivaa ah mente della School of Medicine, “Kore” University of Enna, Geriatric Unit, Department of Medicine e University of Palermo.
Fonte: Nutrients