Fibrosi epatica-Immagine Credit Public Domain-
Un team di ricercatori ha scoperto un meccanismo compensatorio precedentemente sconosciuto presente nelle malattie del fegato. Se le cellule di Kupffer (KC), un tipo specifico di cellule immunitarie presenti nel fegato, vengono danneggiate dalla cicatrizzazione dei tessuti, le cellule immunitarie originarie del midollo osseo fluiscono nell’organo, dove formano cluster di cellule più grandi per svolgere la stessa funzione.
I ricercatori della Cumming School of Medicine dell’Università di Calgary e della Charité-Universitätsmedizin di Berlino hanno osservato per la prima volta come il fegato preserva la sua funzione di filtrazione batterica anche in presenza di malattie. I loro risultati, pubblicati sulla rivista Science, potrebbero contribuire allo sviluppo di nuovi trattamenti per i danni al fegato.
Il fegato è un organo straordinario. L’organo metabolico centrale del corpo, è responsabile sia dell’assorbimento dei nutrienti che della decomposizione delle tossine. Regola il metabolismo dei grassi e degli zuccheri nel corpo e i livelli di minerali, vitamine e ormoni. Oltre a ciò, il fegato svolge un ruolo meno conosciuto, ma comunque vitale come organo immunologico centrale del corpo. Il fegato è determinante nel mantenere il flusso sanguigno umano libero da agenti patogeni: batteri, virus e funghi. In caso di sepsi o avvelenamento del sangue, il fegato filtra oltre il 90% del materiale estraneo coinvolto.
Questa funzione essenziale dell’organo è eseguita da una sorta di cellule immunitarie specializzate: i macrofagi noti come cellule di Kupffer (KC), che prendono il nome dall’anatomista baltico tedesco Karl Wilhelm von Kupffer. Per svolgere la loro funzione di filtraggio, le cellule di Kupffer si trovano nei piccoli vasi sanguigni del fegato, i sinusoidi, dove ricevono segnali continui dalle cellule epatiche stesse e da quelle che rivestono i vasi sanguigni del fegato.
Nelle malattie gravi, in particolare nella malattia epatica cronica, il danno al fegato provoca un accumulo di tessuto cicatriziale in un processo noto come fibrosi, che compromette la funzione dell’organo. Nella fase avanzata di questo processo di rimodellamento dei tessuti, anche l’area attorno alle cellule di Kupffer subisce cambiamenti fatali, con conseguenze finora sconosciute.
Un gruppo di ricerca guidato dall’immunologo Dr. Paul Kubes, Ph.D., della Cumming School of Medicine dell’Università di Calgary, ha collaborato con i colleghi della Charité per indagare su questo fenomeno. Uno dei loro obiettivi principali era migliorare le opzioni terapeutiche future per i pazienti affetti da fibrosi epatica. Le malattie epatiche croniche sono in forte aumento in tutto il mondo. Il consumo eccessivo di alcol e la malattia del fegato grasso sono le principali cause della fibrosi epatica e del suo stadio finale, la cirrosi.
Si stima che una persona su quattro nel mondo soffra già di una malattia del fegato grasso causata da fattori legati allo stile di vita come l’eccessiva assunzione di cibo, la mancanza di esercizio fisico e malattie tra cui il diabete e i disturbi metabolici. Anche infezioni e fattori genetici possono portare alla fibrosi epatica. Sebbene esistano già buoni modelli di malattia epatica, nessuno era ancora riuscito a tracciare contemporaneamente lo sviluppo della fibrosi epatica e la funzione chiave del fegato di filtrazione.
Il ruolo del sistema immunitario nella fibrosi epatica appare sotto una nuova luce
Ora, il team internazionale ha fatto proprio questo. Utilizzando una tecnica di microscopia innovativa che consente di osservare in dettaglio le funzioni cellulari in un organismo vivente e altre tecniche di microscopia, i ricercatori hanno studiato da vicino il funzionamento delle cellule di Kupffer nel modello animale e in campioni di tessuto prelevati da pazienti con cirrosi epatica. Nel processo, hanno identificato un nuovo tipo di cellula, che chiamano sincizi simili alle cellule di Kupffer.
Si tratta di una sorta di cellule giganti: gruppi di cellule più grandi e multinucleati formati da cellule immunitarie originarie del midollo osseo che sono arrivate sulla scena in risposta.
Il Dr. Moritz Peiseler, scienziato e medico del Dipartimento di Epatologia e Gastroenterologia della Charité e primo autore dello studio, descrive ciò che avviene durante la cicatrizzazione e il rimodellamento del fegato: “Il sangue viene reindirizzato verso nuovi vasi dilatati all’interno e all’esterno del fegato. Ciò fa sì che le cellule di Kupffer perdano il contatto con l’ambiente, per cui finiscono per non comportarsi più come se fossero nel fegato. Perdono la loro funzione, non catturano più i batteri dal sangue e le infezioni del flusso sanguigno aumentano. Ma non passa molto tempo prima che monociti specializzati, cellule immunitarie del midollo osseo, si infiltrino nel fegato. Seguono i vasi collaterali che aggirano le strutture precedenti e formano grappoli abbastanza grandi da filtrare i batteri nei vasi un po’ più grandi”.
Si tratta di una forma di compensazione salvavita innescata dal microbioma intestinale.
Da quel momento in poi i sincizi simili a KC appena formati assumono la funzione di filtrazione delle vere e proprie cellule di Kupffer. Poiché devono esistere all’interno dei vasi sanguigni modificati, le cellule immunitarie che sono emigrate nel sito si adattano, formando strutture a rete che le trasformano in un efficace filtro microbico. I ricercatori descrivono nel loro lavoro i meccanismi molecolari coinvolti in questi processi.
“Questi risultati cambiano il modo in cui pensiamo al ruolo del sistema immunitario nella fibrosi epatica”, afferma Kubes, a capo dello studio. “In precedenza, una scuola di pensiero era che si doveva impedire alle cellule immunitarie del midollo osseo di infiltrarsi nel fegato. Ma come mostra il nostro studio, ciò potrebbe essere dannoso. Invece di sopprimere la funzione immunitaria nella malattia avanzata, potrebbe anche essere una buona idea promuoverlo”.
Base per terapie innovative e trattamento della fibrosi epatica
Lo studio è stato condotto in tre grandi centri di trapianto di fegato. Ha dimostrato che i processi coinvolti nella fibrosi epatica negli esseri umani sono simili a quelli osservati nel modello animale. Di conseguenza, queste scoperte sollevano questioni fondamentali per il trattamento dei pazienti con malattia epatica fibrotica.
Le infezioni sono una delle principali cause di morte nei pazienti con cirrosi epatica. Allo stesso tempo, molte persone affette da questo tipo di malattia sperimentano un rimodellamento fibrotico del fegato, in alcuni casi piuttosto avanzato, senza aumento delle infezioni.
“Sospettiamo che il fegato preservi la sua funzione fino a un certo livello di danno reclutando i sincizi simili a KC. In definitiva, anche la formazione di tessuto cicatriziale nel fegato è un meccanismo evolutivamente vantaggioso attraverso il quale un organo danneggiato garantisce la sopravvivenza. Quindi sicuramente è logico che anche il sistema immunitario si adatti”, spiega Peiseler.
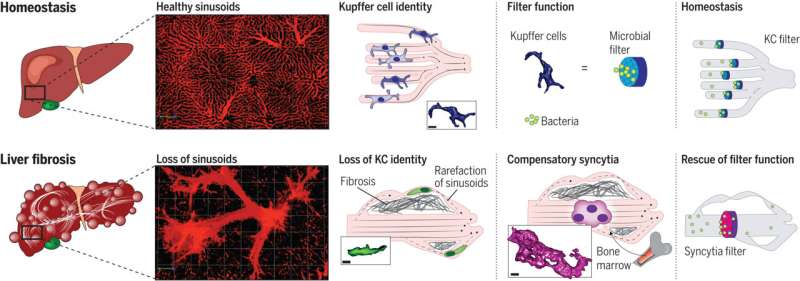
Astratto grafico: adattamento delle cellule di Kupffer nella malattia epatica fibrotica. Nei fegati sani, le KC risiedono nei sinusoidi e catturano rapidamente gli agenti patogeni trasmessi dal sangue. Nella fibrosi epatica, i sinusoidi sono rarefatti, determinando una ridistribuzione della circolazione attraverso i vasi collaterali ad alto flusso. I KC perdono di conseguenza la loro identità e funzione. I monociti quindi seminano vasi più grandi e formano sincizi simili a KC con la maggiore capacità di catturare batteri, fornendo un adattamento di salvataggio alla perdita di KC indotta dalla fibrosi. Credito: Scienza (2023)-
Lo studio attuale contribuisce a una migliore comprensione di come funziona il filtro microbico più importante del corpo quando emerge una malattia epatica, il che potrebbe costituire una base per lo sviluppo di trattamenti innovativi. Poiché sono tagliate fuori dal loro ambiente, le cellule originali di Kupffer non agiscono più come cellule immunitarie epatiche.
Leggi anche:Fibrosi epatica: trovata molecola alla base della condizione
Ciò significa che i ricercatori potrebbero studiare come prevenire questa perdita di identità, che causa anche la perdita di funzioni. Ora è noto anche il modo in cui il fegato risponde al cambiamento patogeno. Sostenere questo processo potrebbe aiutare a proteggere i pazienti, poiché una migliore funzione di filtrazione microbica riduce il rischio di morte per cirrosi epatica e può ritardare il momento del trapianto, che è attualmente l’unica opzione di trattamento disponibile.
Fonte:Science