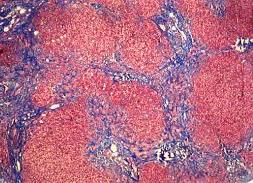
Un fegato sano filtra tutto il sangue nel corpo, scompone le tossine e digerisce i grassi. Produce collagene per riparare le cellule danneggiate quando è ferito. Tuttavia, il fegato può produrre troppo collagene quando un eccessivo accumulo di grasso causa un’infiammazione cronica, una condizione chiamata steatoepatite associata a disfunzione metabolica (MASH). In uno stato avanzato, Le cellule che producono collagene nel fegato sono chiamate cellule stellate epatiche (HSC). In un articolo pubblicato su Cell Metabolism, gli scienziati dell’Università della California a San Diego hanno studiato come vengono attivate queste cellule. Hanno trovato un percorso di segnalazione a tre componenti nel nucleo che funziona secondo una sorta di modello di controllo della polizia.la MASH può portare a cirrosi, cancro al fegato e morte per cause epatiche.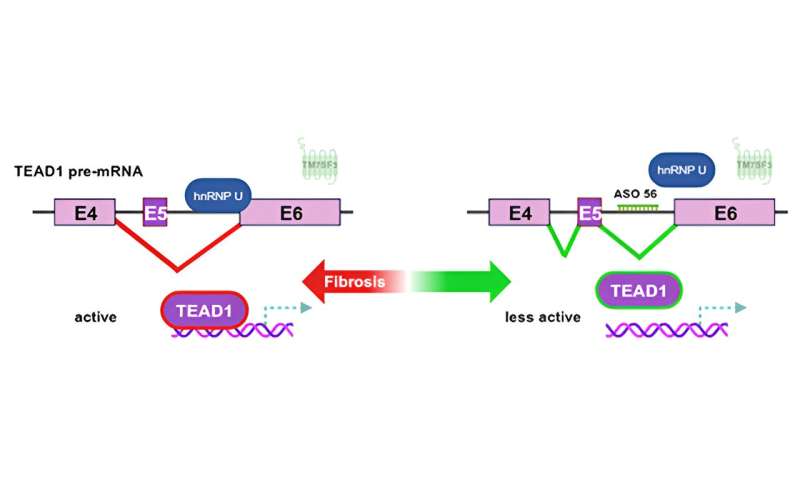
Immagine: schema del modulo di segnalazione TEAD 1 che guida la fibrosi epatica. Credito: UC San Diego Health Sciences
Nei fegati sani, la prima molecola del percorso inibisce una seconda molecola, che inibisce la molecola che stimola i geni che producono collagene. MASH riduce la prima molecola, in modo che l’inibizione venga eliminata sulla seconda e sulla terza molecola, portando alla stimolazione della produzione di collagene.
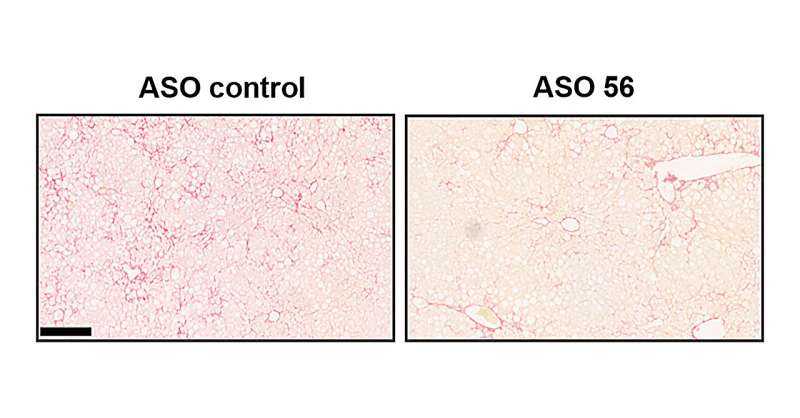
Dopo aver scoperto il percorso di segnalazione, gli scienziati hanno progettato un breve frammento di RNA per dimostrare che il percorso si comportava come pensavano. Questo RNA, chiamato oligonucleotide antisenso (ASO), era così efficace che non solo ha dimostrato la vitalità del percorso, ma ha anche prevenuto la fibrosi epatica (troppo collagene nel fegato) senza causare effetti collaterali.
Gli scienziati stanno attualmente discutendo la concessione di licenza all‘ASO come agente terapeutico con varie aziende farmaceutiche e biotecnologiche.
“Tutte le molecole del percorso erano conosciute, ma nessuno sapeva se o come interagissero. Abbiamo messo insieme il percorso, mostrando ogni passaggio in questo modulo di segnalazione intracellulare. Questa era la scienza della ricerca. Il messaggio clinico è questo ASO, che può effettivamente bloccare la fibrosi epatica”, ha affermato Jerrold Olefsky, Professore di medicina e assistente viceRettore per la ricerca integrativa presso l’UC San Diego Health Sciences e autore senior dell’articolo.
Gli scienziati hanno condotto le loro indagini sugli organoidi: minuscoli fegati in una capsula composta da tre tipi di cellule epatiche alimentate con un cocktail MASH di acidi grassi, fruttosio e zuccheri.
Hanno scoperto che nei fegati normali, il primo componente del percorso, una proteina nucleare a sette transmembrane chiamata TM7SF3, inibisce un fattore di splicing chiamato hnRNPU. hnRNPU si astiene dallo splicing di un esone inibitorio nell’RNA messaggero (mRNA) di TEAD1, un fattore di trascrizione che controlla i geni che producono collagene. L’esone inibitorio, l’esone 5, impedisce a TEAD1 di attivare i geni che producono collagene.
Negli organoidi alimentati con MASH, TM7SF3 è ridotto e non inibisce il fattore di splicing. Il fattore di splicing attivo unisce l’esone inibitorio nel fattore di trascrizione, che attiva i geni che producono collagene. Questo è chiamato splicing alternativo.
Proseguendo le loro indagini, i ricercatori hanno progettato un ASO per impedire a hnRNPU di effettuare lo splicing dell’esone 5. “Aveva la sequenza che lo avrebbe collocato appena a monte dell’esone 5 dove si lega hnRPU. L’ASO ha impedito al fattore di splicing di legarsi all’mRNA di TEAD, quindi alla fine non siamo riusciti a unirlo. Abbiamo ottenuto praticamente solo TEAD inattivo quando abbiamo trattato i topi MASH con l’ASO“, ha detto Olefsky. Con il TEAD inattivato il collagene non veniva prodotto. E nemmeno la fibrosi.
“Questi risultati mostrano il ruolo chiave dello splicing alternativo nel modellare la progressione della malattia epatica fibrotica”, ha affermato Roi Isaac, Ph.D., assistente scienziato del progetto Medicine e primo autore dell’articolo.
Quando gli ASO vengono somministrati per via endovenosa, entrano in ogni cellula del corpo, non solo nelle cellule bersaglio. Casualmente, gli scienziati hanno scoperto che all’interno del fegato questo meccanismo hnRNPU operava solo nelle cellule stellate. Ciò ha reso il loro ASO altamente efficace e altamente specifico: l’epitome di una buona progettazione di farmaci.
Secondo Olefsky, un quarto della popolazione statunitense ha la steatoepatite associata a disfunzione metabolica. Anche se l’ASO proposto dagli scienziati potrebbe essere un trattamento efficace, ottenere l’approvazione della FDA richiederebbe enormi studi clinici e potrebbe costare fino a un miliardo di dollari.
Leggi anche:Fibrosi epatica: verso una terapia migliore
Olefsky e il suo team hanno identificato una malattia molto meno comune chiamata colangite sclerosante primaria o PSC. È relativamente rara, spesso fatale e fino ad ora non esistevano trattamenti validi. Quando gli scienziati hanno testato il loro ASO su un modello murino di PSC, hanno scoperto che il loro ASO bloccava quasi completamente lo sviluppo della malattia.
“Ottenere l’approvazione della FDA per PSC sarebbe più semplice che ottenerla per MASH“, ha affermato Olefsky, “quindi stiamo attualmente parlando con partner biotecnologici e farmaceutici per concedere la licenza all’ASO per PSC“.
Immagine Credit Public Domain.
Fonte:Cell Metabolism