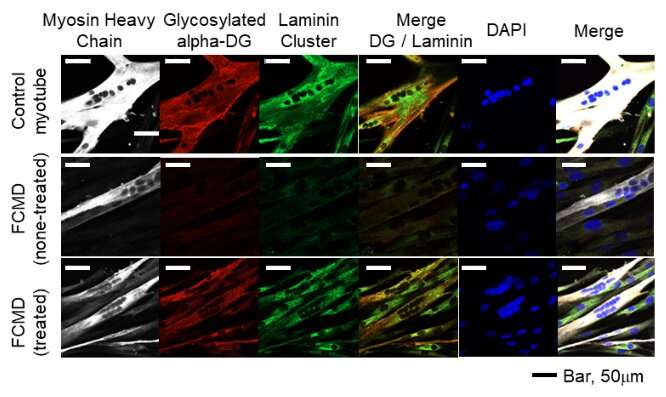
Distrofia muscolare di Fukuyama- Immagine: il trattamento basato su RNAi ripristina la normale produzione di proteine FKTN e la glicosilazione alfa-distroglicano nelle cellule derivate da pazienti con distrofia muscolare di Fukuyama portatori della variante intronica profonda. Credito: Mariko Taniguchi-Ikeda della Fujita Health University-
La distrofia muscolare è una malattia debilitante che provoca un progressivo indebolimento e perdita dei muscoli. La distrofia muscolare di Fukuyama (FCMD), la seconda forma più comune di distrofia muscolare infantile congenita in Giappone, è una grave malattia neuromuscolare caratterizzata da debolezza muscolare generalizzata, diminuzione del tono muscolare, anomalie oculari, malformazione cerebrale, cardiomiopatia, epilessia e convulsioni associate a disabilità.
La FCMD è causata da un’anomalia genetica nel gene “fukutin” (FKTN). I ricercatori giapponesi guidati dalla Dott.ssa Mariko Taniguchi-Ikeda, Prof.ssa associata presso il Dipartimento di genetica clinica del Fujita Health University Hospital, sono stati recentemente in grado di superare questo difetto nel gene FKTN e ripristinare la sua normale funzione biologica.
Utilizzando la tecnica sperimentale chiamata exon skipping mediante oligonucleotidi antisenso, il team ha corretto un errore nel gene FKTN che blocca la glicosilazione chimica di una proteina biologicamente importante. A tal fine, il team ha progettato specifici oligonucleotidi antisenso, piccoli pezzi di DNA o RNA che possono legarsi a specifiche molecole di RNA. I ricercatori hanno quindi condotto esperimenti su cellule derivate da pazienti utilizzando questi oligonucleotidi antisenso per convalidare la loro ipotesi.
Il Dott. Taniguchi-Ikeda spiega: “Ho visto pazienti con FCMD per più di 20 anni. L’obiettivo della nostra ricerca era trovare una cura per questa malattia intrattabile. FCMD è il secondo tipo più frequente di distrofia muscolare infantile nella popolazione giapponese. I nostri studi precedenti mostrano che i pazienti portatori di inserzione retrotrasposale possono essere trattati introducendo oligonucleotidi antisenso”.
“Gli studi clinici sono attualmente in corso. Tuttavia, non sono disponibili metodi terapeutici per i pazienti portatori di una variante eterozigote intronica profonda. I nostri risultati suggeriscono che il salto dell’esone da parte degli oligonucleotidi antisenso come trattamento per i pazienti con la variante intronica profonda ha un enorme potenziale“.
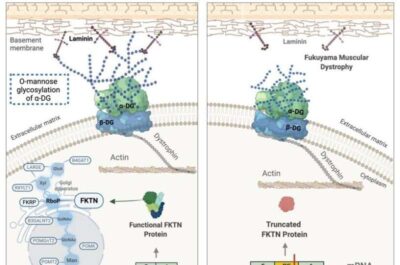
La ricerca si basa su un meccanismo fisiologico che coinvolge FKTN. Il gene FKTN è responsabile della produzione di “ribitol-fosfato transferasi”, un enzima che trasferisce chimicamente un gruppo glicosile all’alfa-distroglicano (α-DG). L’α-DG è una proteina chiave presente nel citoscheletro, una vasta rete di filamenti e tubuli proteici che dà forma e coerenza alle cellule viventi.
L’anomalia genetica nel gene FKTN gli impedisce di esprimere una forma completamente funzionale di transferasi ribitol-fosfato. Questa funzionalità ridotta, a sua volta, blocca un processo critico nel relè biologico: la glicosilazione dell’α-DG. Per inciso, la glicosilazione o l’attaccamento delle molecole di zucchero a frazioni non zuccherine come lipidi e proteine, come l’α-DG in questo caso, è importante per garantire la stabilità strutturale e la funzionalità di queste frazioni.
I risultati dello studio, che sono stati pubblicati su Human Molecular Genetics, hanno implicazioni immediate, dato che gli oligonucleotidi antisenso appositamente progettati, una volta introdotti nelle cellule derivate dal paziente tramite RNAi, sono stati in grado di saltare la regione interessata del gene, ripristinando così la normale produzione della proteina FKTN e successiva glicosilazione di α-DG.
Le terapie radicali per alcuni tipi di disturbi neuromuscolari si sono notevolmente evolute negli ultimi anni. Sebbene fino a poco tempo fa non fossero disponibili terapie efficaci, negli ultimi anni diversi approcci terapeutici sono passati alla fase clinica. Più specificamente, la modulazione farmacologica dello splicing dell’RNA volta a modificare l’elaborazione e la funzione dell’RNA è notevolmente progredita negli ultimi anni.
Vedi anche:Farmaco per il cancro promettente contro la distrofia muscolare
Il coautore dello studio Hiroki Kurahashi, Professore alla Fujita Health University aggiunge: “I pazienti con FCMD che portano il gene FKTN anomalo producono α-DG non glicosilata, che li rende costretti a letto fin dall’adolescenza. Richiedono anche supporto respiratorio, un tubo di alimentazione, e l’assistenza a vita dalle loro famiglie. I nostri esperimenti iniziali sono quindi di fondamentale importanza“.
Incoraggiato dalle scoperte in vitro, il team di ricerca sta ora proponendo un lavoro traslazionale istituendo studi clinici su larga scala che coinvolgono pazienti con FCMD. L’autore principale Sarantuya Enkhjargal, un dottorando studente presso il Fujita Health University Hospital conclude: “La Food and Drug Administration degli Stati Uniti ha approvato otto oligonucleotidi antisenso per il trattamento di diverse malattie. I nostri risultati sono promettenti a livello in vitro. Ulteriori studi sull’efficacia e la sicurezza in vivo nei modelli animali sono necessari prima che questo approccio venga infine utilizzato negli studi clinici“.
Questi risultati, tuttavia, offrono un raggio di speranza per la moltitudine di pazienti e le loro famiglie colpite da questa grave condizione.
Fonte: Human Molecular Genetics