Superbatteri-Immagine Credit Public Domain-
L’urgente crisi dei superbatteri resistenti agli antibiotici è affrontata nella ricerca innovativa di UMass Amherst e Microbiotix. Il loro studio, incentrato sull’interruzione del sistema di secrezione di tipo 3 degli agenti patogeni, offre un nuovo approccio per prevenire le infezioni. Questa strategia, supportata da tecniche innovative basate sulla luciferasi, apre la strada a nuovi farmaci e migliora la nostra comprensione delle infezioni microbiche, segnando un progresso significativo nella salute pubblica. Credito: SciTechDaily.com
Il team sviluppa test per identificare nuovi farmaci in grado di disattivare gli agenti patogeni e quindi ottenere vantaggi reali nella salute pubblica.
I “superbatteri” resistenti agli antibiotici che possono vanificare gli sforzi per ucciderli, rappresentano una crisi urgente per la salute pubblica e, secondo il CDC, ogni anno si verificano più di 2,8 milioni di infezioni resistenti agli antibiotici. I ricercatori di tutto il mondo si stanno affrettando per raccogliere la sfida.
Una svolta nella ricerca sugli agenti patogeni
Recentemente, un team collaborativo di ricercatori guidato dall’Università del Massachusetts Amherst e comprendente scienziati dell’azienda biofarmaceutica Microbiotix, ha annunciato sulla rivista ACS Infectious Diseases di aver imparato con successo come sabotare un pezzo chiave di un meccanismo, chiamato sistema di secrezione di tipo 3, che gli agenti patogeni utilizzano per infettare le cellule ospiti. Inoltre, il team riferisce di aver sviluppato un test per identificare i farmaci di prossima generazione in grado di colpire questo vulnerabile meccanismo cellulare e ottenere vantaggi reali nella salute pubblica.
Sfide nello sviluppo di antibiotici
La strategia tipica nel trattamento delle infezioni microbiche è quella di distruggere l’agente patogeno con un farmaco antibiotico, che agisce penetrando nella cellula dannosa e uccidendola. Questo non è così facile come sembra, perché ogni nuovo antibiotico deve essere sia idrosolubile, in modo che possa viaggiare facilmente attraverso il flusso sanguigno, sia oleoso, per attraversare la prima linea di difesa della cellula patogena, la membrana cellulare. Acqua e olio, ovviamente, non si mescolano ed è difficile progettare un farmaco che abbia abbastanza di entrambe le caratteristiche per essere efficace.
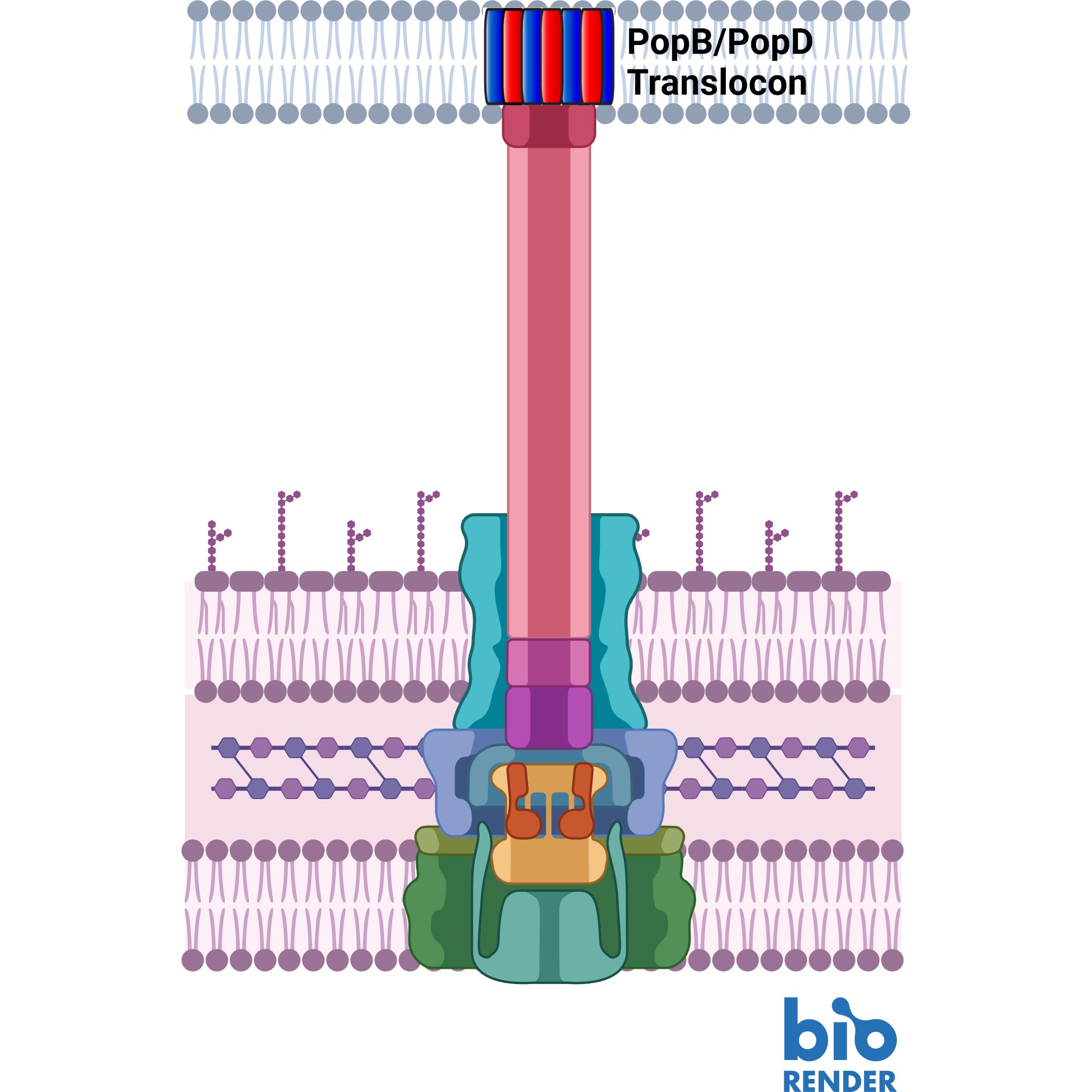
Il sistema di secrezione di tipo 3 dipende da due proteine, PopB e PopD (rossa e blu) che creano un tunnel nella parete cellulare dell’ospite. Credito: UMass Amherst
Le difficoltà non finiscono qui, perché le cellule patogene hanno sviluppato una strategia chiamata “pompa di efflusso”, in grado di riconoscere gli antibiotici e poi espellerli in modo sicuro dalla cellula, dove non possono causare alcun danno. Se l’antibiotico non riesce a superare la pompa di efflusso e uccide la cellula, l’agente patogeno “ricorda” l’aspetto di quello specifico antibiotico e sviluppa ulteriori pompe di efflusso per gestirlo in modo efficiente, diventando in effetti resistente a quel particolare antibiotico.
Strategie alternative contro i superbatteri
Una strada da percorrere è trovare un nuovo antibiotico, o una combinazione di essi, e cercare di stare un passo avanti rispetto ai superbatteri.
“Oppure possiamo cambiare la nostra strategia“, afferma Alejandro Heuck, Professore associato di biochimica e biologia molecolare all’UMass Amherst e autore senior dell’articolo. “Sono un chimico e sono sempre stato molto interessato a capire come le molecole chimiche interagiscono con gli organismi viventi. In particolare, ho concentrato la mia ricerca sulle molecole che rendono possibile la comunicazione tra un agente patogeno e la cellula ospite che vuole invadere”.
“Se non proviamo a uccidere l’agente patogeno, non c’è alcuna possibilità che sviluppi resistenza. Stiamo solo sabotando la sua macchina. L’agente patogeno è ancora vivo; è semplicemente inefficace e l’ospite ha il tempo di utilizzare le sue difese naturali per sbarazzarsi dell’agente patogeno”, afferma Alejandro Heuck, Professore associato di biologia molecolare.
Heuck e i suoi colleghi sono stati particolarmente interessati a un sistema di comunicazione chiamato sistema di secrezione di tipo 3 che, finora, sembra essere un adattamento evolutivo esclusivo dei microbi patogeni.
Comprendere l’interazione tra ospite e patogeno
Come la cellula patogena, anche le cellule ospiti hanno pareti cellulari spesse e difficili da penetrare. Per superarle, gli agenti patogeni hanno sviluppato una macchina simile a una siringa che secerne prima due proteine, note come PopD e PopB.
Né PopD né PopB singolarmente possono sfondare la parete cellulare, ma le due proteine insieme possono creare un “translocone”, l’equivalente cellulare di un tunnel attraverso la membrana cellulare. Una volta stabilito il tunnel, la cellula patogena può iniettare altre proteine che svolgono il lavoro di infettare l’ospite.
L’intero processo è chiamato sistema di secrezione di tipo 3 e non funziona senza PopB e PopD. “Se non cerchiamo di uccidere l’agente patogeno”, afferma Heuck, “non c’è alcuna possibilità che sviluppi resistenza. Stiamo solo sabotando la sua macchina. L’agente patogeno è ancora vivo; è semplicemente inefficace e l’ospite ha il tempo di utilizzare le sue difese naturali per sbarazzarsi dell’agente patogeno”.
La domanda, quindi, è: come trovare la molecola in grado di bloccare l’assemblaggio del translocone?
A volte, le soluzioni arrivano agli scienziati in quei “momenti di luce” in cui improvvisamente tutto ha un senso. In questo caso, è stato più un momento fulmineo.
Approccio di ricerca innovativo
Heuck e i suoi colleghi si resero conto che una classe di enzimi chiamata luciferasi, simili a quelli che fanno brillare i fulmini di notte, poteva essere usata come tracciante. Hanno diviso l’enzima in due metà. Una metà è stata inserita nelle proteine PopD/PopB e l’altra metà è stata ingegnerizzata in una cellula ospite.
Leggi anche:Superbatteri: antibiotico ultima risorsa li fa scoppiare
Queste proteine e ospiti ingegnerizzati possono essere inondati da diversi composti chimici. Se la cellula ospite si illumina improvvisamente, significa che PopD/PopB ha violato con successo la parete cellulare, riunendo le due metà della luciferasi, facendole brillare. Ma se le celle restano buie? “Allora sappiamo quali molecole interrompono il translocone“, afferma Heuck.
Implicazioni e supporto per la ricerca
Heuck si affretta a sottolineare che la ricerca del suo team non ha solo ovvie applicazioni nel mondo dei prodotti farmaceutici e della sanità pubblica, ma che fa anche avanzare la nostra comprensione di come esattamente i microbi infettano le cellule sane. “Volevamo studiare come funzionavano gli agenti patogeni”, dice, “e poi all’improvviso abbiamo scoperto che le nostre scoperte possono aiutare a risolvere un problema di salute pubblica“.
Astratto grafico

Immagine Credito ACS Infectious Diseases-
Spiegano gli autori:
“Lo Pseudomonas aeruginosa multiresistente ai farmaci rappresenta una seria minaccia per i pazienti ospedalizzati. Questo organismo esprime un arsenale di fattori di virulenza che gli consente di stabilire facilmente infezioni e di diffonderle nell’ospite. Il sistema di secrezione di tipo 3 (T3SS) e i suoi effettori associati svolgono un ruolo cruciale nella patogenesi di P. aeruginosa, rendendoli bersagli attraenti per lo sviluppo di nuovi agenti terapeutici. Il traslocone T3SS, composto da PopD e PopB, è un componente essenziale dell’apparato di secrezione T3SS. Nel traslocone opportunamente assemblato, l’N-terminale di PopD sporge nel citoplasma della cellula di mammifero bersaglio, che può essere sfruttata come indicatore molecolare dell’assemblaggio funzionale del traslocone. In questo articolo, descriviamo un nuovo test basato su cellule intere che utilizza il sistema di rilevamento della luciferasi NanoLuc diviso per fornire una lettura per l’assemblaggio del translocone. Il test dimostra un rapporto segnale/rumore favorevole (13,6) e robustezza ( Z ′ = 0,67), che lo rendono particolarmente adatto per lo screening ad alto rendimento di inibitori di piccole molecole mirati all’assemblaggio del traslocone T3SS“.
Fonte:ACS Infectious Diseases