Cancro-Immagine Credit Public Domain-
I ricercatori del Dipartimento di Chimica, Scripps Research, California, hanno scoperto come sfruttare il potere tossico del plancton per produrre molecole antitumorali.
In un articolo, “La sintesi delle portimine rivela le basi della loro attività anti-cancro“, pubblicato su Nature, il team descrive in dettaglio i passaggi compiuti nella sintesi delle tossine marine, portimina A e portimina B, consentendo indagini approfondite sulle loro proprietà.
Le tossine imminiche cicliche derivate dai dinoflagellati, in particolare la portimina A e la portimina B, sono interessanti per le loro potenziali proprietà terapeutiche antitumorali. Precedenti ricerche avevano dimostrato gli effetti delle tossine imminiche cicliche sulle cellule tumorali, ma i meccanismi molecolari alla base della causa dell’attività antitumorale erano sconosciuti.
L’accesso a queste tossine in grandi quantità è attualmente difficile da ottenere poiché l’unico produttore conosciuto è un tipo di minuscolo plancton marino, Vulcanodinium rugosum. Per testare l’attività della tossina, i ricercatori dovevano prima innovare un modo per sintetizzare quantità sufficientemente grandi con cui lavorare.
La sintesi è iniziata con la costruzione di uno scheletro di carbonio minimamente decorato, privo della maggior parte degli atomi di ossigeno. L’idea era di “sfruttare la reattività innata di un macrociclo per installare il modello di ossigenazione e la stereochimica corretti”.
Sono stati impiegati eventi strategici di tautomerizzazione (fenomeno per il quale due (o più) isomeri di un composto entrano rapidamente in equilibrio fra loro, in soluzione o in fase liquida convertendosi l’uno nell’altro della catena ad anello), per facilitare la sintesi utilizzando la metatesi degli alchini (composti organici a catena aperta costituiti solamente da atomi di carbonio e di idrogeno) a chiusura dell’anello per costruire il macrociclo a 14 membri nello scheletro delle portimine. L’innovazione rappresenta una sintesi scalabile e concisa di portimine. Una volta create le molecole desiderate, il passo successivo è stato vedere come queste interagivano con le cellule tumorali.
Il team ha testato le interazioni attraverso un ampio campione di 20 linee cellulari di cancro umano e di topo, che vanno dalla leucemia di Jurkat alle cellule di fibrosarcoma umano metastatico, al cancro al seno triplo negativo e alle linee cellulari di glioblastoma che iniziano il tumore al cervello. È stata osservata una potente attività citotossica costante nell’intero pannello di linee cellulari tumorali valutate con la portimina A. La portimina B completamente sintetica è risultata sostanzialmente meno efficace.
La portimina A è stata identificata come un potente induttore dell’apoptosi in varie linee cellulari tumorali, comprese le cellule MC38, un modello di test per il carcinoma del colon-retto. L’apoptosi causata dalla portimina A ha avuto effetti minimi sulle cellule non cancerose e una bassa tossicità nei topi.
Nello specifico, è stato scoperto che la portimina A prende di mira la proteina di esportazione ribosomiale 60S NMD3, bloccando la formazione di polisomi e inibendo la traduzione proteica ed è stato osservato che è un agente efficace per sopprimere la crescita del tumore in vivo.
Il tempo di esposizione alla portimina A era limitato dalla sua emivita di circa 30 minuti. La breve durata ha comunque comportato una significativa riduzione della crescita del tumore, indicando un’attività molto potente e potenziali usi terapeutici in futuro.
Esperimenti di proteomica hanno rivelato che la proteina di esportazione ribosomiale NMD3 è il bersaglio e necessaria per l’attività citotossica della portimina A. NMD3 è coinvolto nell’assemblaggio dei ribosomi.
Leggi anche:Ricercatori scoprono come l’arginina guida il cancro al fegato
La portimina A agiva per stabilizzare NMD3 in modo dose-dipendente, portando a una diminuzione dei livelli di proteine specifiche del cancro, MYC e MCL-1. Questa diminuzione si è verificata senza influenzare i livelli di mRNA di MYC e MCL1, suggerendo che PA inibisce la traduzione, non la trascrizione, di queste proteine.
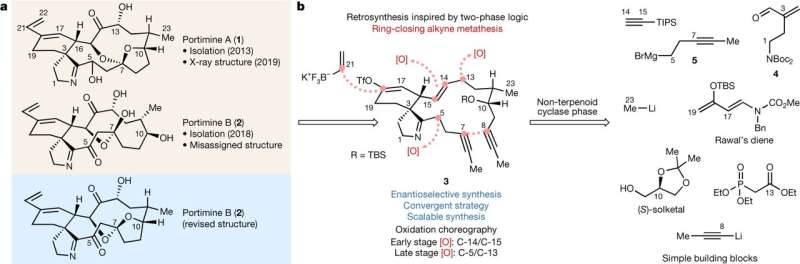
Astratto Grafico:a, Struttura chimica di PA e PB riportati (in beige) e struttura rivista di PB (in blu). b, una retrosintesi mirata a un intermedio minimamente ossidato (3) porta a semplici elementi costitutivi disponibili in commercio, che imitano la sintesi bifase dei terpenoidi. Credito: Natura-
Come per ogni buona ricerca, i risultati indicano che sono necessarie ulteriori ricerche. Gli autori suggeriscono che queste indagini future dovrebbero valutare se i tumori maligni di alcune espressioni genetiche disregolate sono più vulnerabili alla portimina A e se esistono applicazioni terapeutiche sinergiche come osservato con altri inibitori della traduzione.
Fonte: Nature