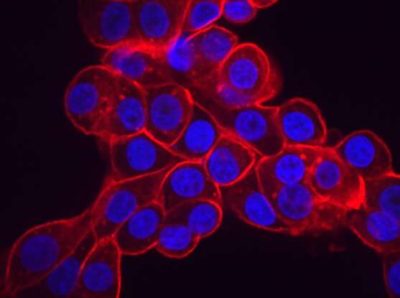
(Tumori ovarici e uterini-Immagine:le cellule tumorali ovariche sovraesprimono livelli elevati della proteina importatrice di fosfato SLC34A2 (rossa) che pompa il fosfato in una cellula e la lascia vulnerabile all’inibizione dell’esportazione di fosfato. I nuclei cellulari sono mostrati in blu. Attestazione: Daniel Bondeson).
Sebbene le prospettive per le persone con alcuni tipi di cancro siano migliorate negli ultimi 20 anni, i risultati per le pazienti con cancro ovarico e uterino e ovarico rimangono più o meno gli stessi. Le pazienti spesso hanno una malattia avanzata prima della diagnosi e i geni che guidano la formazione del tumore si sono rivelati difficili da individuare con nuovi trattamenti.
Ora, i ricercatori del progetto Cancer Dependency Map (DepMap) del Broad Institute del MIT e di Harvard hanno identificato una vulnerabilità nascosta nei tumori ovarici e uterini, nonché un modo per sfruttarla che potrebbe ispirare nuovi farmaci tanto necessari per questi tumori.
Un team guidato dal Direttore dell’Istituto Todd Golub e dal Direttore della DepMap Francisca Vazquez ha studiato 851 linee cellulari tumorali umane per cercare i geni su cui i tumori uterini e ovarici fanno affidamento per sopravvivere, noti come “dipendenze”. Gli scienziati sapevano già che le cellule tumorali dell’utero e dell’ovaio hanno livelli elevati di una proteina chiamata SLC34A2 che importa il fosfato nelle cellule. Il team di Golub ha disabilitato un’altra proteina in queste cellule, chiamata XPR1, che esporta il fosfato dalle cellule, e ha scoperto che questo le uccideva. I risultati dello studio, pubblicati su Nature Cancer, suggeriscono che il gene XPR1 è una vulnerabilità genetica in queste cellule e che l’accumulo di fosfato potrebbe essere tossico per le cellule. Il team aggiunge che l’interruzione del trasporto del fosfato nelle cellule tumorali, ad esempio con una proteina utilizzata per disabilitare l’XPR1 nei loro esperimenti, potrebbe essere una strategia di trattamento efficace.
“Le pazienti con cancro ovarico hanno un disperato bisogno di terapie migliori e questa scoperta di XPR1 è sia sorprendente che entusiasmante come punto di partenza per la scoperta di farmaci”, ha affermato Golub, che ha co-Diretto il progetto. “La sfida ora sarà convertire questa scoperta in una strategia terapeutica“.
“Questo è un altro ottimo esempio di una nuova vulnerabilità del cancro identificata dalla Cancer Dependency Map che non avrebbe potuto essere identificata semplicemente sequenziando i genomi”, ha affermato Francisca Vazquez, co-autore senior dello studio. “È un altro passo verso il nostro obiettivo di mappare l’intero panorama della vulnerabilità al cancro“. I co-primi autori dello studio Daniel Bondeson e Brent Paolella hanno affermato che la mappa della dipendenza dal cancro ha permesso loro di illuminare i percorsi biologici e aprire nuove domande in modo imparziale.
“L’idea che l’omeostasi del fosfato sia qualcosa che puoi prendere di mira nel cancro è qualcosa che nessuno ha apprezzato prima“, ha detto Bondeson, un ricercatore post-dottorato nel laboratorio di Golub.
“Alla fine, abbiamo appreso alcune basi fondamentali della biologia cellulare”, ha aggiunto Paolella, che era ricercatrice senior presso Broad quando è iniziato lo studio. “Ma abbiamo anche trovato opportunità di sviluppo terapeutico. E questo è un buon esempio di ciò che puoi fare con la mappa delle dipendenze“.
Inondazione di fosfati
Il fosfato, un singolo atomo di fosforo circondato da quattro atomi di ossigeno, è essenziale per la vita, presente nelle ossa e nei denti e nella spina dorsale del DNA. Sebbene studi precedenti abbiano dimostrato che le cellule del cancro ovarico hanno livelli anormalmente elevati della proteina importatrice di fosfato SLC34A2, la proteina è presente in altri tessuti come i polmoni e l’intestino, quindi bersagliarla con farmaci potrebbe causare effetti collaterali.
Per trovare un obiettivo migliore per future terapie, il team si è concentrato sulla ricerca di una vulnerabilità unica per le cellule tumorali uterine e ovariche. Hanno analizzato gli schermi CRISPR di DepMap che mostrano gli effetti della disabilitazione dei geni chiave nelle cellule tumorali. Tra 851 linee cellulari, hanno osservato che le cellule tumorali uterine e ovariche avevano maggiori probabilità di morire rispetto ad altre cellule quando XPR1, che codifica per l’unica proteina nota per esportare il fosfato dalle cellule, è stata disattivata. In particolare, le cellule con XPR1 inattivato morivano solo se importavano anche grandi quantità di fosfato. Inoltre, in queste cellule, l’altra caratteristica molecolare più frequentemente riscontrata erano gli alti livelli della proteina importatrice.
Successivamente, il team di Golub ha trovato prove di una qualche correlazione tra importatori ed esportatori di fosfato nei dati dei pazienti archiviati.
“Questa relazione”, hanno detto Bondeson e Paolella, “ha suggerito un’ipotesi chiara: che l’accumulo di fosfato stesso fosse tossico”.
Vedi anche:Cancro dell’utero: l’eccesso di peso raddoppia il rischio
Verso le cure
Di ritorno in laboratorio, il team ha testato questa teoria. In modelli cellulari ovarici e uterini, hanno scoperto che le cellule facevano affidamento su XPR1 per sopravvivere quando avevano un’elevata espressione del gene importatore. E quando disabilitavano l’XPR1 o lo inibivano con una proteina, le cellule accumulavano fosfato, crescevano più lentamente e alla fine morivano.
Gli scienziati hanno affermato che la proteina che hanno usato per inibire l’XPR1 potrebbe, con un ulteriore sviluppo, essere un potenziale trattamento per questi tumori e il laboratorio di Golub continuerà a studiare se tali proteine sono una strategia terapeutica praticabile.
“Alcune dipendenze genetiche del cancro ovarico sono difficili da prendere di mira con i farmaci, ma abbiamo dimostrato che possiamo effettivamente utilizzare una proteina per mirare all’XPR1 e uccidere le cellule tumorali”, ha detto Bondeson. “E questo è davvero eccitante”.
Il team ha anche osservato che la dipendenza da XPR1 era fortemente correlata alla dipendenza da un altro gene chiamato KIDINS220, che è coinvolto nello sviluppo neurale, ma non era stato precedentemente collegato al trasporto del fosfato. I ricercatori pensano che XPR1 e KIDINS220 si uniscano per formare un complesso proteico coinvolto nel trasporto del fosfato fuori dalle cellule. Questa connessione offre una vasta gamma di altre domande: KIDINS220 potrebbe anche essere preso di mira da nuovi farmaci? E le malattie legate a KIDINS220 comportano problemi con la regolazione del fosfato?
Bondeson e Paolella hanno affermato che il coinvolgimento di KIDINS220 nel trasporto del fosfato suggerisce che c’è molto da imparare su come XPR1 e KIDINS220 interagiscono tra loro e con il fosfato e, soprattutto, che ci sono ancora profonde lacune nella comprensione scientifica di come le cellule percepiscono, regolano e immagazzinano il fosfato. Hanno aggiunto che è necessario chiarire come esattamente l’accumulo di fosfato uccida le cellule. Ad esempio, hanno notato insolite sacche racchiuse nella membrana nelle immagini al microscopio di cellule cariche di fosfato. Non sanno se quelle sacche, o vacuoli, immagazzinano fosfato extra o sono un segno di morte imminente.
“Siamo ancora molto confusi su queste strutture, ma in modo eccitante”, ha detto Paolella. “Il nostro lavoro ha rivelato che alcune domande basilari sull’omeostasi del fosfato sono ancora senza risposte”.
Fonte:Nature Cancer