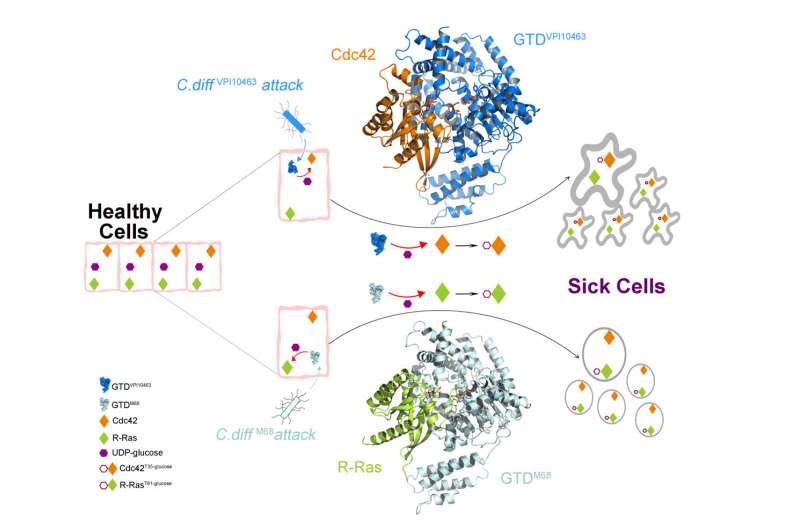
(C.difficile-Immagine:VPI10463 e l’M68 rappresentano rispettivamente il C. difficile classico e ipervirulento. GTD-VPI modifica preferenzialmente le GTPasi della famiglia Rho (Cdc42, per esempio) mediante glucosilazione, mentre GTD-M68 modifica più efficacemente R-Ras. A causa della loro diversa selettività verso le GTPasi della famiglia Rho o Ras, queste due diverse varianti di TcdB causano due distinti tipi di effetti citopatici. Credito: UCI School of Medicine).
o Clostridioides difficile (precedentemente Clostridium difficile ) è una delle minacce urgenti di resistenza agli antibiotici identificate dai Centri statunitensi per il controllo e la prevenzione delle malattie. L’ infezione da C. difficile (CDI) causa manifestazioni cliniche che vanno dalla diarrea lieve alla colite pseudomembranosa pericolosa per la vita, che è diventata la principale causa di diarrea infettiva associata all’assistenza sanitaria e ha rappresentato un notevole onere finanziario per il sistema sanitario degli Stati Uniti. La patologia del CDI è principalmente mediata da due esotossine omologhe, la tossina A (TcdA) e la TcdB, che distruggono l’epitelio del colon, portando a diarrea e colite. Sebbene i ruoli relativi di queste due tossine nella patogenesi del CDI non siano completamente compresi, la tossina TcdB è considerata più virulento del TcdA poiché la solo TcdB è in grado di causare l’intero spettro di malattie negli esseri umani e i ceppi TcdA – TcdB + sono stati clinicamente isolati.
Ora, uno studio condotto dall’Università della California, Irvine, suggerisce che il dominio della glucosiltransferasi (GTD) è un bersaglio molecolare ideale per interventi terapeutici per l’infezione da C.difficile (CDI). Questi risultati possono portare a nuovi trattamenti per combattere questa malattia mortale.
Sulla base delle loro scoperte che hanno stabilito le basi strutturali per il riconoscimento della tossina B delle piccole famiglie GTPases Rho e R-Ras, lo studio, intitolato “Structural based for Selective modification of Rho and Ras GTPases by Clostridioides difficile toxin B“, è stato pubblicato oggi in Progressi scientifici.
C.difficile, la principale causa di decessi associati a diarrea e gastroenterite associate agli antibiotici in tutto il mondo, con 500.000 casi e 29.000 decessi all’anno negli Stati Uniti, è stato classificato dai Centers for Disease Control and Prevention come una delle principali minacce per la salute. C’è una crescente preoccupazione globale riguardo all’emergere e alla diffusione di ceppi ipervirulenti di C. difficile, che assomigliano al verificarsi di nuove varianti del virus nell’attuale pandemia di COVID. TcdB è una delle due esotossine omologhe di C. difficile e TcdB da solo è in grado di causare l’intero spettro delle malattie da CDI.
Vedi anche:Clostridium difficile: zuccheri dietetici collegati all’aumento delle epidemie
“Ci siamo concentrati sulla struttura e sulla funzione del il dominio della glucosiltransferasi cruciale di TcdB, che è la ‘testata’ della tossina. GTD viene rilasciato dalla tossina all’interno delle cellule ospiti e causa la maggior parte del danno citosolico ai pazienti“, ha affermato Rongsheng Jin, Ph.D., Professore presso il Dipartimento di Fisiologia e Biofisica presso la Scuola di Medicina dell’UCI e autore corrispondente. “Abbiamo scoperto i meccanismi molecolari attraverso i quali il GTD riconosce e blocca in modo specifico le funzioni fisiologiche delle famiglie di enzimi GTPasi umane Rho e R-Ras che sono molecole di segnalazione cruciali“.
Il team ha anche dimostrato come la forma classica di TcdB e l’ipervirulento TcdB riconoscano i loro bersagli umani in modi diversi, il che porta a cambiamenti strutturali distinti nelle cellule ospiti causati dall’invasione batterica.
“Una volta che GTD di TcdB è all’interno delle cellule, è schermato dalle nostre cellule e diventa inaccessibile all’immunoterapia passiva. Ma i nostri studi suggeriscono che potrebbero essere sviluppati inibitori per disarmare GTD, che elimineranno direttamente la causa principale dei sintomi della malattia. e danni cellulari”, ha detto Jin. “Questa nuova strategia può potenzialmente essere integrata e complementare ad altri reggimenti di trattamento del C.difficile”.
Spiegano gli autori:
“La tossina B (TcdB) è una delle principali cause di Clostridioides difficileinfezione (CDI). Questa tossina agisce glucosilando piccole GTPasi nelle famiglie Rho/Ras, ma le basi strutturali per il riconoscimento e la selettività di TcdB di specifici substrati GTPasi rimangono irrisolte. Riportiamo qui, le strutture cocristallo del dominio glucosiltransferasi (GTD) di due distinte varianti di TcdB nel complesso con Cdc42 umano e R-Ras, rispettivamente. Queste strutture rivelano un meccanismo strutturale comune mediante il quale TcdB riconosce Rho e R-Ras. Inoltre, troviamo un raggruppamento selettivo dei cambiamenti dei residui adattivi nei GTD che determinano le loro preferenze di substrato, il che aiuta a suddividere tutte le varianti TcdB note in due gruppi che mostrano specificità distinte verso Rho o R-Ras. Le mutazioni che interrompono selettivamente il legame delle GTPasi riducono l’attività della glucosiltransferasi della GTD e la tossicità dell’olotossina TcdB“.
Fonte:Science Advances