Gli scienziati che indagano le radici molecolari della malattia di Alzheimer hanno scoperto che le mutazioni del gene chiamato TREM2 possono aumentare sostanzialmente il rischio della malattia di una persona. La cattiva notizie è che nelle prime fasi della malattia, le varianti TREM2 possono ostacolare la capacità del sistema immunitario di proteggere il cervello dalla beta amiloide, una proteina chiave associata all’Alzheimer.
La buona notizia, secondo i ricercatori della School of Medicine di Washington, a St. Louis, è che più tardi nella malattia, quando il cervello è invaso da agenti tossici di un’altra proteina dell’ Alzheimer nota come tau, l’assenza della proteina TREM2 sembra proteggere il cervello dai danni. I topi senza TREM2 subiscono molto meno danni al cervello rispetto a quelli con la proteina.
( Vedi anche:Alzheimer: ApoE4 non è il solo fattore di rischio genetico).
Secondo i risultati di questo studio, il target TREM2 può essere utilizzato sia per prevenire che per curare la malattia di Alzheimer.
“Le persone che studiano l’Alzheimer hanno già cercato di sviluppare modi per raggiungere TREM2”, ha affermato David Holtzman, Professore e capo del Dipartimento di Neurologia. “Ora che abbiamo questi dati, la domanda è: “Che cosa è meglio fare? Stimolare o inibire?”.
Lo studio è stato pubblicato online il 9 ottobre in Proceedings of the National Academy of Sciences.
Le placche beta-amiloide iniziano a formarsi nel cervello dei pazienti con Alzheimer anni prima che i sintomi caratteristici come la perdita di memoria e la confusione, appaiano. Le placche stesse sembrano fare danni minimi: molte persone anziane rimangono mentalmente nitide, nonostante le placche abbondanti, ma la loro presenza aumenta il rischio di sviluppare aggregati tau, il vero motore della distruzione. Il cervello inizia a morire specificamente nelle aree in cui Tau non funziona correttamente.
Normalmente, le proteine tau presenti nei neuroni formano brevi filamenti che contribuiscono, con i microtubuli, a stabilizzare la struttura della cellula (citoscheletro), ma che servono soprattutto a facilitare l’espulsione dalla cellula di proteine potenzialmente tossiche, instradandole verso l’esterno.

Quando la proteina tau è anomala, questa espulsione ordinata degli scarti metabolici della cellula non avviene più. Di conseguenza, all’interno del neurone si accumulano diverse proteine, fra cui la beta amiloide. A questo punto la cellula tenta comunque di espellere le proteine attraverso altri meccanismi, che però, essendo meno efficienti, non riescono a eliminarle tutte e non impediscono alle beta amiloidi (che sono “appiccicose”) di aderire una all’altra durante l’espulsione, formando le tipiche placche attorno ai neuroni.
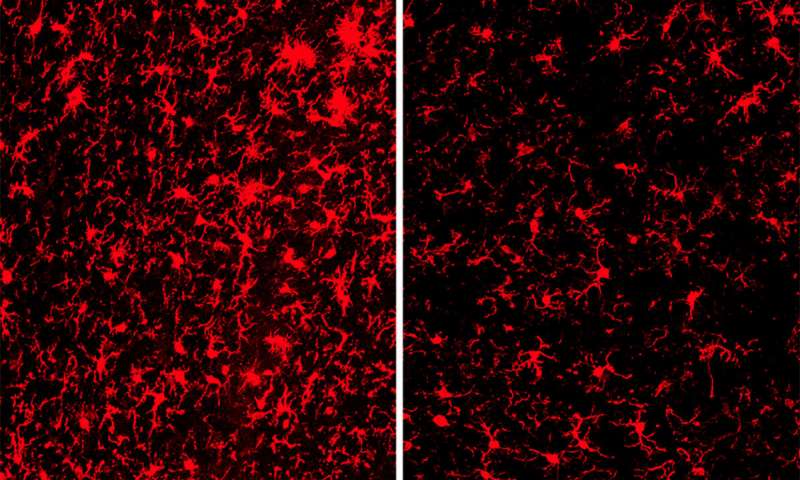
Nel cervello, la proteina TREM2 si trova solo sulle cellule immunitarie note come microglia. Holtzman, insieme a Marco Colonna, Robert Rock Belliveau, Professore di patologia e immunologia e altri, hanno dimostrato che quando TREM2 è assente, le cellule immunitarie non possono generare l’energia necessaria per limitare la diffusione della placche beta amiloide.
Sapendo che tau svolge un ruolo fondamentale nello sviluppo dell’ Alzheimer, Holtzman, Cheryl Leyns e Jason Ulrich, Assistente Professore di neurologia, hanno deciso di indagare l’effetto di TREM2 su Tau.
I ricercatori hanno utilizzato topi geneticamente modificati che trasportano una forma mutante di Tau umano che crea grumi tossici. Hanno inattivato il gene TREM2 in alcuni dei topi in modo che di beta amiloide, ma solo alcuni topi avevano anche la proteina TREM2 nella loro microglia.
A 9 mesi di età, i cervelli dei topi con TREM2 erano notevolmente ridotti, in particolare nelle aree importanti per la memoria. Ci sono stati notevolmente meno danni nei topi senza TREM2.
A sorpresa, i ricercatori hanno scoperto che non c’era alcuna differenza significativa nella quantità di placche amiloidi nei due gruppi di topi. Al contrario, la differenza fondamentale sembrava essere nelle cellule immunitarie che rispondevano a tali placche. La microglia nei topi con TREM2 è stata attiva, rilasciando composti che in alcune circostanze aiutano a combattere la malattia, ma in questo caso sono stati principalmente feriti e uccisi i neuroni vicini. La microglia nei topi senza TREM2 era molto meno attiva ed i loro neuroni erano relativamente stati risparmiati dai danni.
“Una volta che abbiamo individuato la differenza nell’attivazione della microglia, abbiamo cominciato a capire che il danno danno non ha a che fare con l’aggregazione beta amiloide necessariamente, ma con la risposta del sistema immunitario all’aggregazione“, ha dichiarato Leyns, primo autore dello studio .
I risultati suggeriscono che le stesse cellule immunitarie possono essere coinvolte sia nella protezione che nella promozione di danni neurologici nei pazienti con Alzheimer.
“Sembra che l’attivazione della microglia abbia ruoli molto diversi in diverse impostazioni”, ha detto Holtzman. ” Le beta amiloidi sembrano avviare la malattia. ma quando hai meno funzione TREM2 e quindi meno funzione della microglia, maggiori sono rischi di sviluppare l’Alzheimer”.
Per anni, i medici hanno cercato di prevenire o curare la malattia di Alzheimer puntando alle placche amiloidi o a tau, ma nessuna terapia si è ancora dimostrata efficace. Quando TREM2 è stato identificato come un fattore di rischio importante quattro anni fa, gli scienziati lo hanno utilizzato per affrontare la malattia in modo nuovo.
Questi risultati indicano che il tentativo di trattare l’Alzheimer con il target della funzione TREM2 e l’attivazione microgliale può essere la svolta per un nuovo trattamento.
Fonte: PNAS