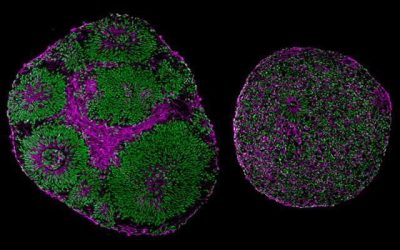
(Autismo-Immagine: le immagini al microscopio rivelano differenze significative in termini di dimensioni e struttura tra gli organoidi cerebrali derivati da un paziente con sindrome di Pitt-Hopkins (a destra) e da un controllo (a sinistra). Credito: UC San Diego Scienze della salute).
In uno studio pubblicato il 2 maggio 2022 su Nature Communications, gli scienziati della San Diego School of Medicine dell’Università della California hanno utilizzato organoidi del cervello umano per rivelare come una mutazione genetica associata a una forma profonda di autismo interrompe lo sviluppo neurale. L’uso degli strumenti di terapia genica per recuperare la funzione del genE ha salvato efficacemente la struttura e la funzione neurale.
Diverse malattie neurologiche e neuropsichiatriche, inclusi i disturbi dello spettro autistico (ASD) e la schizofrenia, sono state collegate a mutazioni nel fattore di trascrizione 4 (TCF4), un gene essenziale nello sviluppo del cervello. I fattori di trascrizione regolano l’attivazione o disattivazione di altri geni, quindi la loro presenza o meno può avere un effetto domino nell’embrione in via di sviluppo. Tuttavia, si sa poco su cosa succede al cervello umano nell’autismo, quando il gene TCF4 è mutato.
Vedi anche:Autismo: alcuni sintomi legati agli astrociti
Per esplorare questa domanda, i ricercatori si sono concentrati sulla sindrome di Pitt-Hopkins, un ASD specificamente causato da mutazioni nel TCF4. I bambini con la condizione genetica hanno profonde disabilità cognitive e motorie e sono tipicamente non verbali.
I modelli murini esistenti della sindrome di Pitt-Hopkins non riescono a imitare accuratamente le caratteristiche neurali dei pazienti, quindi il team dell’UC San Diego ha invece creato un modello di ricerca umana del disturbo. Usando la tecnologia delle cellule staminali, i ricercatori hanno convertito le cellule della pelle dei pazienti in cellule staminali che sono state poi sviluppate in organoidi cerebrali tridimensionali o “mini-cervelli”.
Le osservazioni iniziali degli organoidi cerebrali hanno rivelato una serie di differenze strutturali e funzionali tra i campioni mutati in TCF4 e i loro controlli.
“Anche senza un microscopio, potresti dire quale organoide cerebrale aveva la mutazione“, ha affermato l’autore senior dello studio Alysson R. Muotri, Ph.D., Professore alla UC San Diego School of Medicine, Direttore del programma UC San Diego Stem Cell e membro del Sanford Consortium for Regenerative Medicine.
Gli organoidi mutati in TCF4 erano sostanzialmente più piccoli dei normali organoidi e molte delle cellule non erano in realtà neuroni, ma progenitori neurali. Queste semplici cellule hanno lo scopo di moltiplicarsi e poi maturare in cellule cerebrali specializzate, ma negli organoidi mutati, parte di questo processo è andato storto.
Una serie di esperimenti ha rivelato che la mutazione TCF4 ha portato alla disregolazione a valle dei geni SOX e del percorso Wnt, due importanti segnali molecolari che guidano le cellule embrionali a moltiplicarsi, maturare in neuroni e migrare nella posizione corretta nel cervello.
A causa di questa disregolazione, i progenitori neurali non si sono moltiplicati in modo efficiente e quindi sono stati prodotti meno neuroni corticali. Le cellule che sono maturate in neuroni erano meno eccitabili del normale e spesso sono rimaste raggruppate insieme invece di organizzarsi in circuiti neurali finemente sintonizzati.
Questa architettura cellulare atipica ha interrotto il flusso dell’attività neurale nell’organoide cerebrale mutato, che secondo gli autori potrebbe contribuire a compromettere la funzione cognitiva e motoria su tutta la linea.
“Siamo rimasti sorpresi di vedere problemi di sviluppo così importanti a tutte queste diverse scale e ci siamo chiesti cosa potremmo fare per affrontarli”, ha detto il primo autore dello studio Fabio Papes, Ph.D., Professore associato presso l’Università di Campinas e in visita presso la UC San Diego School of Medicine, che ha supervisionato congiuntamente il lavoro con Muotri. Papes ha un parente con la sindrome di Pitt-Hopkins, che lo ha motivato a studiare il TCF4.
Il team ha testato due diverse strategie di terapia genica per recuperare il gene funzionale nel tessuto cerebrale. Entrambi i metodi hanno effettivamente aumentato i livelli di TCF4 e, così facendo, hanno corretto i fenotipi della sindrome di Pitt-Hopkins su scala molecolare, cellulare ed elettrofisiologica.
“Il fatto che possiamo correggere questo gene e l’intero sistema neurale si ristabilisce, anche a livello funzionale, è sorprendente”, ha detto Muotri.
Muotri osserva che questi interventi genetici hanno avuto luogo in una fase prenatale dello sviluppo cerebrale, mentre in un contesto clinico i bambini avrebbero ricevuto la diagnosi e il trattamento alcuni anni dopo. Pertanto, gli studi clinici devono prima confermare se un intervento successivo è ancora sicuro ed efficace. Il team sta attualmente ottimizzando i propri strumenti di terapia genica recentemente autorizzati in preparazione per un tale studio, in cui si spera che le iniezioni spinali del vettore genetico recuperino la funzione del TCF4 nel cervello.
“Per questi bambini e i loro cari, varrebbe la pena provare qualsiasi miglioramento della funzione motorio-cognitiva e della qualità della vita”, ha affermato Muotri.
“Ciò che è veramente eccezionale di questo lavoro è che questi ricercatori stanno andando oltre il laboratorio e stanno lavorando duramente per rendere questi risultati traducibili nella clinica”, ha affermato Audrey Davidow, Presidente della Pitt Hopkins Research Foundation. “Questo è molto più di un documento accademico stellare; è una vera misura di ciò che la scienza ben praticata può realizzare per cambiare, si spera, la vita umana in meglio”.
Fonte:Nature