Proteina tau.
La proteina tau è una proteina associata ai microtubuli, ampiamente presente nel sistema nervoso centrale. Svolge un ruolo chiave nel mantenimento e nella regolazione della struttura e della funzione dei neuroni.
Nelle malattie neurodegenerative, l’aggregazione anomala delle proteine Tau porta alla formazione di grovigli neurofibrillari. Questi grovigli compromettono l’integrità neuronale e contribuiscono alla morte cellulare e alla progressione della malattia.
Per sviluppare nuovi metodi diagnostici e approcci terapeutici per il trattamento di queste malattie neurodegenerative, è essenziale studiare il ruolo della proteina Tau e la sua successiva aggregazione e formazione di grovigli neurofibrillari.
Il ruolo critico della proteina Tau nel citoscheletro neuronale
I neuroni sono cellule complesse le cui funzioni e strutture dipendono dalla riorganizzazione dinamica del citoscheletro.
Il citoscheletro aiuta le cellule a mantenere la loro forma e organizzazione interna, gestita individualmente dai singoli elementi al suo interno. I microfilamenti resistono alla tensione, i microtubuli mantengono la forma cellulare e facilitano il trasporto del carico, mentre i filamenti intermedi ancorano gli organelli.
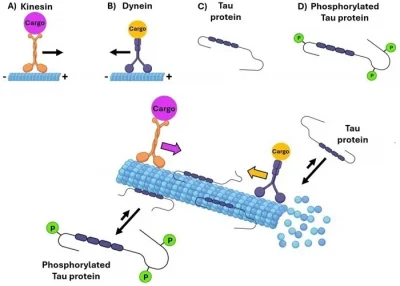
La proteina tau agisce legandosi ai microtubuli negli assoni, favorendone l’assemblaggio, prevenendone la depolimerizzazione e migliorandone la stabilità.
La funzione della tau è finemente regolata da modificazioni post-traduzionali, in particolare dalla fosforilazione, che riduce l’affinità della proteina per i microtubuli e ne influenza la dinamica. Questo processo è essenziale per il corretto funzionamento neuronale.
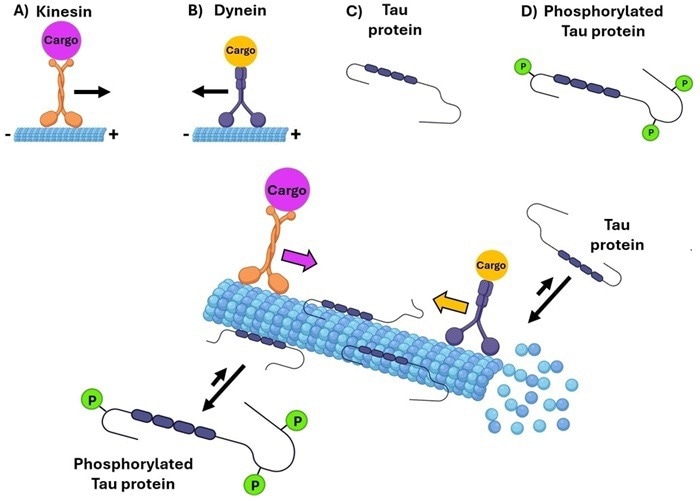
Figura 1. Ruolo della proteina tau nella stabilità e nel trasporto dei microtubuli. Fonte immagine: https://doi.org/10.1002/cmdc.202400180
Caratteristiche strutturali della proteina Tau
Le proteine tau sono costituite da quattro domini primari: il dominio di proiezione N-terminale, la regione ricca di prolina, il dominio di legame ai microtubuli (MBD) e la regione C-terminale.
Il dominio N-terminale contribuisce alla stabilità assonale interagendo con altri componenti del citoscheletro e con le membrane cellulari.
La regione ricca di prolina contiene siti di fosforilazione che regolano la segnalazione neurale e la comunicazione intracellulare.
L’MBD determina l’affinità di legame della Tau con i microtubuli, mentre la regione C-terminale supporta l’MBD nel mantenimento della stabilità e della funzionalità dei microtubuli.
Lo splicing alternativo produce sei isoforme di Tau con diversi inserti N-terminali (0N, 1N, 2N) e ripetizioni MBD (3R o 4R). Ogni isoforma ha funzionalità distinte, in particolare nella capacità di legarsi ai microtubuli.
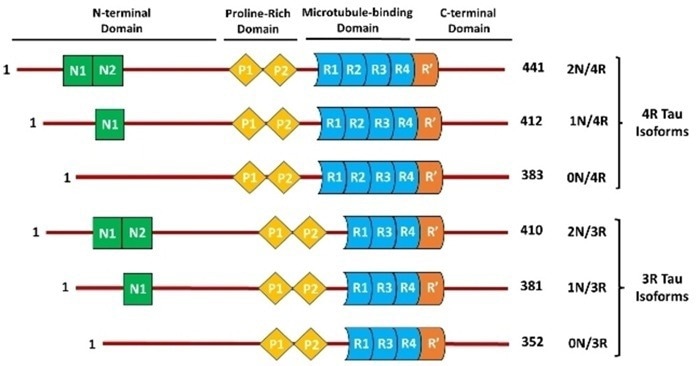
Figura 2. Sei isoforme di Tau sono generate tramite splicing alternativo. Crediti immagine: https://doi.org/10.1002/cmdc.202400180
Proteina Tau e malattie neurodegenerative
La proteina tau nella malattia di Alzheimer
La malattia di Alzheimer (MA) è la malattia neurodegenerativa più diffusa tra gli anziani, caratterizzata da un’anomala fosforilazione della proteina Tau. Le proteine Tau fosforilate si staccano dai microtubuli, aggregandosi in grovigli neurofibrillari e compromettendo le strutture neuronali. Questa compromissione porta ai sintomi caratteristici della malattia di Alzheimer: perdita di memoria e declino cognitivo.
Anche l’accumulo di beta-amiloide (Aβ) è fortemente caratteristico dell’AD. La ricerca indica una forte correlazione tra la patologia della tau e l’accumulo di Aβ.
Nelle fasi iniziali dell’AD, si formano placche di Aβ tra i neuroni, innescando infiammazione e stress ossidativo. Questo promuove la fosforilazione e l’aggregazione della proteina Tau, che può portare a un’esacerbazione della tossicità di Aβ, innescando un circolo vizioso che accelera la progressione dell’AD.
Figura 3. Interazione di Aβ e Tau nell’AD. Fonte immagine: https://doi.org/10.7150/ijbs.57078
Proteina tau nel morbo di Parkinson
Il morbo di Parkinson (MP) è la seconda malattia neurodegenerativa più comune, caratterizzata principalmente dall’aggregazione anomala di α-sinucleina (α-syn) in corpi di Lewy. Questa aggregazione provoca la progressiva perdita di neuroni dopaminergici .
Nuove prove suggeriscono che anche la proteina Tau contribuisce alla patologia del morbo di Parkinson.
La ricerca ha dimostrato che la proteina Tau interagisce con la proteina α-sin, accelerandone l’aggregazione. Le fibrille preformate (PFF) di Tau e α-sin miste mostrano un’attività di propagazione più forte rispetto alle PFF di α-sin da sole, inducendo disfunzione mitocondriale, compromissione sinaptica e neurotossicità. Studi autoptici su pazienti con Parkinson (PD) confermano questa teoria della co-localizzazione di Tau e α-sin nei corpi di Lewy.
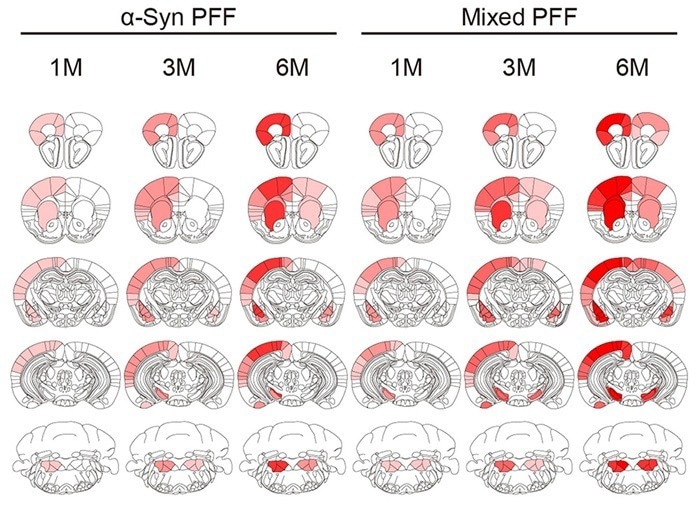
Figura 4. Mappa di calore dei punteggi patologici di pS129 nei cervelli di topi iniettati con diversi PFF. Crediti immagine: https://doi.org/10.1093/brain/awac171
pS129 è un sito di fosforilazione su α-sin e un marcatore dell’aggregazione di α-sin. La mappa di calore mostra la distribuzione e la gravità della patologia α-sin nelle regioni cerebrali di topi iniettati con PFF α-sin o PFF misti Tau/α-sin. Le aree più rosse indicano una patologia più grave, mentre i PFF misti Tau/α-sin causano una patologia α-sin più ampia e grave.
Proteina tau nella malattia di Huntington (HD)
La malattia di Huntington (MH) è un’altra malattia neurodegenerativa comune. A differenza dell’Alzheimer e del Parkinson, la MH è causata da mutazioni nel gene huntingtina (HTT). È caratterizzata da disfunzione motoria, declino cognitivo e sintomi psichiatrici.
Sebbene la fosforilazione della proteina Tau non sia un indicatore di HD, sono state osservate anomalie nella fosforilazione e nell’aggregazione della proteina Tau nelle fasi avanzate della malattia. La proteina huntingtina mutante (mHtt) può alterare la regolazione della proteina Tau, portando a questa fosforilazione e aggregazione osservate.
Anche i rapporti alterati delle isoforme Tau 4R/3R nella corteccia e nello striato dei pazienti affetti da HD suggeriscono che lo splicing errato della Tau sia associato alla patologia HD.
Leggi anche:La proteina Tau identificata come responsabile della malattia di Alzheimer
Riepilogo
La proteina tau è essenziale per la stabilità dei microtubuli e la funzione neuronale. La disfunzione della proteina è collegata a diverse malattie neurodegenerative, come Alzheimer, Parkinson e HD.
Per supportare la ricerca sui meccanismi della proteina Tau e sulle patologie correlate, AcroBiosystems offre una vasta gamma di prodotti Tau di alta qualità, tra cui proteine Tau selvatiche, mutanti e fosforilate, PFF di Tau, linee cellulari stabili di Tau e anticorpi p-tau. Questi prodotti AcroBiosystems soddisfano le diverse esigenze della ricerca di base e dello sviluppo di farmaci.
Credito immagine: ACROBiosystems
Credito immagine: ACROBiosystems
Credito immagine: ACROBiosystems
Riferimenti
- Di Lorenzo, D. (2024). Proteina Tau e tauopatie: esplorazione delle interazioni proteina Tau-proteina e microtubuli, interazioni crociate e strategie terapeutiche. ChemMedChem , 19(21). https://doi.org/10.1002/cmdc.202400180 .
- Yang, J., Zhi, W. e Wang, L. (2024). Ruolo della proteina Tau nelle malattie neurodegenerative e sviluppo dei suoi farmaci mirati: una revisione della letteratura. Molecules , (online) 29(12), pp. 2812–2812. https://doi.org/10.3390/molecules29122812 .
- Zhang, H., et al . (2021). Interazione tra Aβ e Tau nella patogenesi della malattia di Alzheimer. International Journal of Biological Sciences , (online) 17(9), pp. 2181–2192. https://doi.org/10.7150/ijbs.57078 .
- Pan, L., et al . (2022). La tau accelera l’aggregazione e la diffusione dell’α-sinucleina nel morbo di Parkinson. Brain: A Journal of Neurology , (online) 145(10), pp. 3454–3471. https://doi.org/10.1093/brain/awac171 .
- Singh, S., et al . (2025). Targeting della proteina tau nell’Alzheimer e oltre: approfondimenti sulla patologia e sulle strategie terapeutiche. Ageing Research Reviews , 104, p.102639. https://doi.org/10.1016/j.arr.2024.102639 .
Informazioni su ACROBiosystems
ACROBiosystems è un’azienda fondamentale nel settore farmaceutico e biotecnologico. La sua missione è contribuire a superare le sfide con strumenti e soluzioni innovativi, dalla fase di scoperta alla fase clinica. Fornisce strumenti per le scienze della vita progettati per essere utilizzati nella ricerca di scoperta e scalabili fino alla fase clinica e oltre. Adattandosi costantemente alle nuove sfide e linee guida normative, ACROBiosystems fornisce soluzioni, che si tratti di proteine ricombinanti, anticorpi, kit di analisi, reagenti di grado GMP o servizi personalizzati. ACROBiosystems supporta scienziati e ingegneri impegnati nell’innovazione per semplificare e accelerare lo sviluppo di farmaci nuovi, migliori e più accessibili.