Un motivo strutturale che si trova in due farmaci anti-cancro potrebbe essere responsabile della loro capacità di affrontare i tumori e degli effetti collaterali causati da tali farmaci.
Gli organelli chiamati mitocondri sono spesso indicati come la centrale elettrica di una cellula perché formano le molecole di ATP che la cellula utilizza come fonte di energia. Gli effetti collaterali tossici di alcuni farmaci sono causati dal farmaco che interrompe inavvertitamente il funzionamento dei mitocondri (Nadanaciva e Will, 2011). Il cuore è particolarmente suscettibile a tali effetti collaterali perché le cellule cardiache contengono un gran numero di mitocondri per soddisfare le richieste energetiche del tessuto cardiaco. Capire come si manifesta questa tossicità è importante in modo che possa essere evitata durante la progettazione e lo sviluppo di nuovi trattamenti. Tuttavia, può essere difficile determinare quale parte del farmaco causa questi effetti collaterali tossici.
Vedi anche:Nuova particella in grado di monitorare il percorso dei farmaci chemioterapici
Ora, Anne Willis (Università di Cambridge) e colleghi – tra cui Zoë Stephenson come primo autore – riportano i dettagli di una struttura chimica nel farmaco antitumorale Mubritinib che inibisce i mitocondri delle cellule cardiache e provoca un aumento non intenzionale della tossicità. Precedenti lavori avevano dimostrato che Mubritinib interrompe la fosforilazione di una proteina chiamata HER2 che è nota per promuovere la crescita delle cellule tumorali. Tuttavia, durante i test, i ricercatori hanno scoperto che l’aumento della concentrazione di Mubritinib non ha ostacolato questa proteina nella stessa misura di un farmaco chiamato Lapatinib, che è noto per agire inibendo HER2. Ciò ha suggerito che Mubritinib non inibisce direttamente HER2 e che è probabile che un altro meccanismo sia responsabile dei suoi effetti anti-cancro.
Poiché Mubritinib è noto per influenzare i percorsi che sono collegati all’energia cellulare, i ricercatori – che hanno sede presso l’Università di Cambridge e l’Università di Nottingham – hanno deciso di indagare su come questo farmaco ha influenzato la produzione di ATP nelle cellule cardiache coltivate in due mezzi: il glucosio e galattosio. Le cellule coltivate nel galattosio dipendono maggiormente dai mitocondri per la produzione di ATP rispetto alle cellule coltivate nel glucosio, quindi sono più suscettibili ai composti che prendono di mira questo organello. I ricercatori hanno scoperto che, in seguito al trattamento farmacologico, le cellule del galattosio producevano meno ATP e avevano una frequenza di battito inferiore rispetto alle cellule del glucosio. Ciò suggerisce che Mubritinib altera l’attività della catena di trasporto degli elettroni che guida la sintesi di ATP (Figura 1). Ulteriori analisi hanno rivelato che Mubritinib inibisce una particolare struttura all’interno di questa catena chiamata “complesso I”.
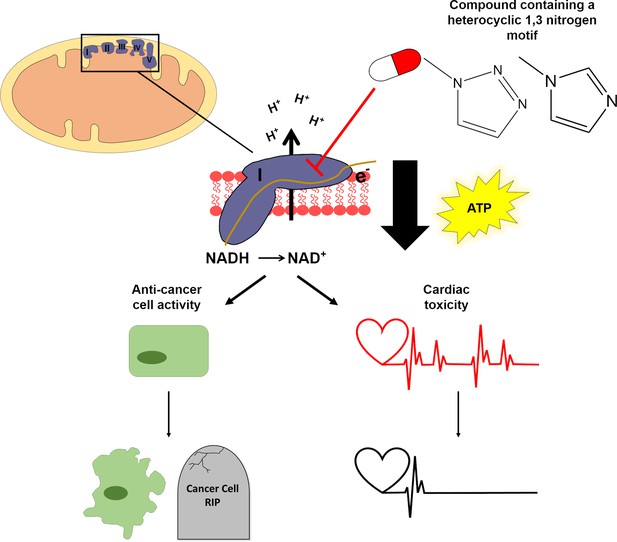
Un motivo strutturale in due farmaci anti-cancro interrompe la produzione di ATP.
I mitocondri (in alto a sinistra) producono le molecole di ATP che forniscono energia alle cellule. Catene di complessi proteici chiamati trasportatori di elettroni (viola; etichettati I, II, III, IV e V) sono incorporati nel …
Successivamente, Stephenson e colleghi hanno studiato un elenco di composti che hanno una struttura simile a Mubritinib per identificare il “tossicoforo”, la regione del farmaco che causa gli effetti collaterali. Lo studio ha rivelato che una regione chiamata motivo eterociclico dell’azoto 1,3 era responsabile dell’inibizione del complesso I e della riduzione della produzione di ATP (Figura 1).
I ricercatori hanno quindi studiato gli effetti di un farmaco anti-cancro chiamato Carbossiammidotriazolo che contiene la stessa struttura tossicoforo. Si pensa che questo farmaco blocchi la progressione del cancro inibendo specifici canali ionici che trasportano gli ioni calcio nella cellula. Tuttavia, Stephenson et al. hanno scoperto che il Carbossiammidotriazolo non si lega in modo significativo ai canali del calcio, ma riduce la produzione di ATP nei mezzi di galattosio e diminuisce la quantità di ossigeno assorbita dalle cellule cardiache.
Infine, per identificare se il motivo eterociclico dell’azoto 1,3 fosse responsabile degli effetti anti-cancro di entrambi i farmaci, i ricercatori hanno misurato la crescita e il tasso di morte delle cellule tumorali dopo il trattamento. Le linee cellulari che rappresentano cinque diversi tipi di cancro sono state trattate con Mubritinib, Carbossiammidotriazolo o composti strutturalmente simili privi del tossicoforo. In ciascuna linea cellulare testata, la presenza del tossicoforo ha determinato un aumento dei livelli di morte cellulare e una riduzione dei tassi di crescita cellulare (Figura 1). Ciò suggerisce che il tossicoforo in questi due farmaci è anche parzialmente responsabile dei loro effetti anti-cancro.
Questi risultati forniscono la prova di un motivo chimico che aumenta la tossicità delle cellule cardiache prendendo di mira inavvertitamente i mitocondri. L’identificazione di questo motivo potrebbe aiutare a progettare trattamenti anti-cancro più sicuri ed efficaci. Inoltre, il metodo utilizzato in questo studio potrebbe essere utilizzato per identificare altri motivi chimici che interrompono specificamente l’attività dei mitocondri. La ricerca futura dovrebbe testare una più ampia quantità di composti contenenti questo tossicoforo per confermare se la perdita di attività mitocondriale è collegata ad effetti collaterali negativi. Inoltre, è importante valutare se questi effetti causano solo tossicità nel cuore o se anche altri organi, come il fegato e i reni, possono essere sensibili.
Fonte:elifesciences