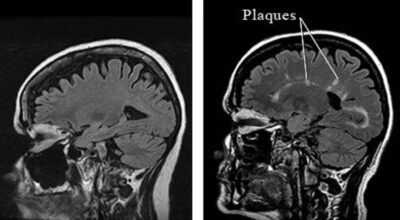
SM-Immagine Credit Public Domain-
Mediante lo screening CRISPR, i ricercatori della LMU hanno fornito la prima caratterizzazione molecolare completa dell’infiltrazione delle cellule T nel sistema nervoso centrale delle persone con SM.
La sclerosi multipla (SM) è la malattia invalidante più comune del sistema nervoso centrale (SNC) nei giovani adulti. La malattia inizia quando le cellule T autoreattive attivate si infiltrano nel sistema nervoso centrale e innescano una cascata di lesioni tissutali. L’importanza di questa infiltrazione di cellule T è ben evidenziata da studi condotti su modelli di malattia nei roditori e nell’uomo.
“Nonostante questa conoscenza, non avevamo una comprensione completa delle molecole essenziali che regolano la migrazione delle cellule T autoreattive verso il sistema nervoso centrale“, afferma Martin Kerschensteiner, Direttore dell’Istituto di neuroimmunologia clinica della LMU. Si trattava di un deficit di conoscenze a cui un team guidato da Kerschensteiner e Naoto Kawakami del Centro biomedico della LMU di Monaco ha cercato di porre rimedio.
Spiegano gli autori:
“La SM è la malattia neurologica invalidante più comune nei giovani adulti. Nella SM, la cascata di lesioni tissutali inizia quando le cellule T autoreattive attivate si infiltrano nel sistema nervoso centrale. L’importanza di questo passaggio nella patogenesi della SM è ben evidenziata da studi condotti su modelli di malattia nei roditori e negli esseri umani. La capacità delle cellule T CD4 + di indurre l’infiammazione del sistema nervoso centrale è stata, ad esempio, dimostrata in modelli sperimentali di encefalomielite autoimmune (EAE) su roditori, in cui cellule T attivate che riconoscono la proteina basica della mielina (MBP) vengono trasferite in roditori naïve dove inducono una malattia simile alla SM. Esperimenti in tali modelli hanno delineato il percorso migratorio delle cellule T encefalitogene verso il sistema nervoso centrale; abbiamo scoperto i compartimenti e le interazioni cellulari che determinano l’induzione dell’infiammazione del sistema nervoso centrale e hanno contribuito all’identificazione di molecole di adesione, come l’integrina α4, necessarie per la migrazione delle cellule T al sistema nervoso centrale. I dati clinici hanno confermato l’importanza di questi processi negli individui con SM, dimostrando che si prevede che molti dei loci genetici che conferiscono un aumento del rischio della malattia influenzino l’attivazione e la differenziazione delle cellule T CD4 +; che esiste una firma genetica immunitaria associata alla SM in un sottogruppo di cellule T CD4 + in gemelli monozigoti discordanti per la malattia; che le cellule T iniziano a colonizzare il sistema nervoso centrale sin dalle prime fasi della malattia e che le terapie mirate alla migrazione delle cellule T possono essere efficaci nel migliorare la SM. Nonostante i significativi progressi nella nostra comprensione della SM e delle modalità di trattamento, la maggior parte degli studi fino ad oggi si sono concentrati sulla valutazione e sulla convalida del ruolo delle molecole note per essere coinvolte nel traffico di cellule T. Tuttavia, ciò ha lasciato lacune fondamentali nella conoscenza del campo e manca una comprensione completa dei segnali molecolari essenziali e dei flussi di segnalazione che consentono o limitano l’ingresso delle cellule T nel sistema nervoso centrale e possono quindi rappresentare bersagli alternativi per la terapia. L’avvento della tecnologia di editing genetico CRISPR ora aumenta la possibilità di condurre screening completi e imparziali sulla perdita di funzione in modelli di malattia in vivo: infatti gli screening CRISPR sull’intero genoma sono stati utilizzati con successo per rispondere a domande relative all’inizio, alla propagazione e alla terapia del cancro, nonché per rivelare i meccanismi che regolano i processi immunologici critici, tra cui l’attivazione, la proliferazione e la determinazione del destino delle cellule T. Ad oggi, questo potente approccio non è stato applicato per studiare l’inizio dell’infiammazione del sistema nervoso centrale nella SM“.
Come riportato su Nature Neuroscience, i ricercatori sono stati in grado di identificare cinque inibitori essenziali e 18 facilitatori essenziali della migrazione delle cellule T al sistema nervoso centrale utilizzando un’analisi dell’intero genoma.
Schermata CRISPR in vivo dell’intero genoma nel modello di ratto
I ricercatori di Monaco hanno utilizzato un approccio di editing genetico che non era mai stato utilizzato in precedenza in relazione ai modelli di SM. “La tecnologia CRISPR aumenta la possibilità di condurre screening completi e imparziali della perdita di funzione in modelli di malattia in vivo“, spiega Kawakami. Prima d’ora, gli screening CRISPR dell’intero genoma sono stati ampiamente utilizzati nelle indagini relative alla patogenesi del cancro, ma non ancora in relazione alla SM.
“Abbiamo utilizzato un modello di SM di roditore e combinato uno screening CRISPR imparziale dell’intero genoma con studi di validazione funzionale in vivo, microscopia multifotonica ed esperimenti meccanicistici in vitro, per fornire una caratterizzazione molecolare definita della fase centrale nella patogenesi della SM, l’infiltrazione di sostanze autoreattive cellule T nel sistema nervoso centrale“, afferma Kawakami.
In totale, i ricercatori hanno identificato cinque inibitori essenziali e 18 facilitatori essenziali di questo meccanismo.
Fondamentalmente, questi regolatori possono essere ascritti a tre categorie funzionali, necessarie affinché una cellula T possa passare dal sangue al cervello. L’adesione delle cellule T all’endotelio dei vasi sanguigni attraverso la molecola integrina alfa-4 è un processo importante all’inizio della trasmigrazione.
Nella fase successiva, le cellule T escono dal vaso sanguigno. Il loro movimento è controllato da messaggeri riconosciuti da una proteina specifica, il recettore delle chemochine CXCR3. La terza categoria funzionale riguarda le molecole che regolano il modo in cui le cellule T registrano i segnali attrattivi dal sangue.
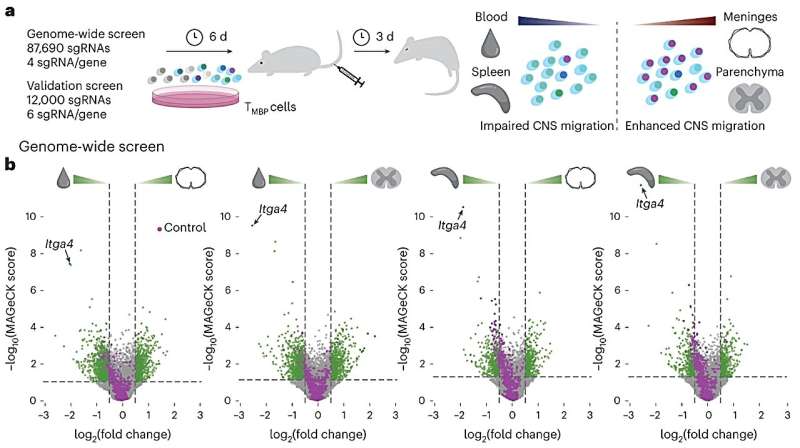
Astratto grafico: lo screening CRISPR dell’intero genoma identifica i geni essenziali per la migrazione delle cellule T autoreattive al sistema nervoso centrale. a, disegno sperimentale. Le cellule TMBP sono state trasdotte in vitro con le librerie CRISPR dell’intero genoma o di convalida, selezionate positivamente, riattivate e iniettate per via endovenosa nei ratti Lewis. Dopo 3 giorni, all’esordio della malattia, sono stati raccolti dal sangue, dalla milza, dalle meningi del midollo spinale e dal parenchima per l’analisi. b, grafici di Volcano che descrivono i risultati dello screening dell’intero genoma per gene attraverso quattro confronti di tessuti. I punti verdi rappresentano i geni il cui KO ha mostrato un cambiamento considerevole nella capacità delle cellule TMBP di migrare nel sistema nervoso centrale. I punti lilla indicano i controlli. Linee con valore P = 0,05 e log2 (modifica piega) = ±0,5. Credito: Nature Neuroscience-
Secondo Kerschensteiner, i vantaggi dello studio sono duplici. “La nostra indagine ha confermato per le cellule T autoreattive che abbiamo studiato che le molecole chiave del meccanismo sono già il bersaglio delle terapie per la SM e vengono impiegate nella pratica clinica”.
Leggi anche:SM: la N-acetilglucosamina ripristina la funzione neurologica
“Inoltre“, aggiunge, “l’approccio adottato dai ricercatori, che ora è stato validato anche per quanto riguarda la trasferibilità all’uomo, può essere applicato ad altre questioni meno conosciute, come la migrazione di altre popolazioni di cellule immunitarie dannose dal sangue al sistema nervoso, all’organismo“.
Fonte: Nature Neuroscience