SLA-Immagine Credit Public Domain-
 Credito: Cell Reports-
Credito: Cell Reports-
Punti salienti della ricerca:
- •Aumento della lunghezza dell’AIS e ipereccitabilità intrinseca nei motoneuroni hiPSC della SLA
- •Compromissione della plasticità dell’AIS e della regolazione omeostatica dell’eccitabilità nei neuroni della SLA
- •Aumento delle contrazioni spontanee delle miofibre delle unità motorie hiPSC ALS in vitro
- •Progressione verso l’accorciamento dell’AIS e l’ipoeccitabilità nei motoneuroni hiPSC della SLA tardiva.
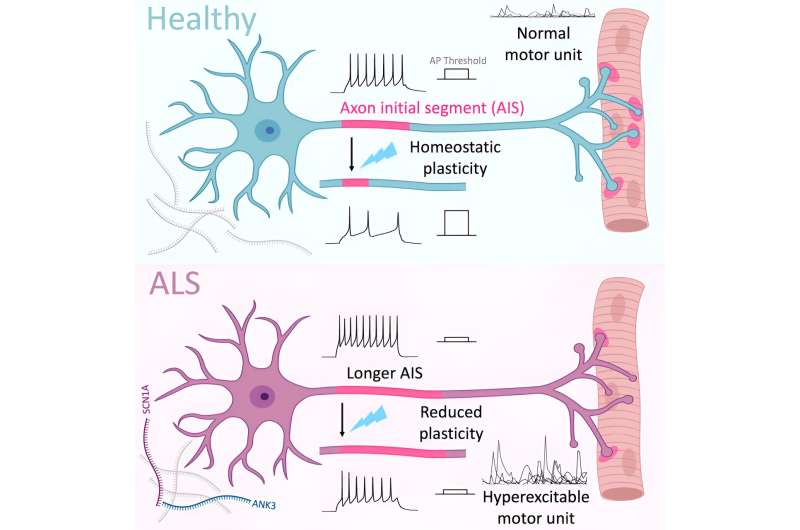
Un nuovo studio, pubblicato su Cell Reports, riporta un nuovo meccanismo dietro l’attività neuronale disregolata, una patologia chiave della sclerosi laterale amiotrofica (SLA). I ricercatori del King’s College di Londra hanno scoperto che “i cambiamenti molecolari, strutturali e funzionali nel segmento iniziale dell’assone (AIS) determinano un’eccitabilità neuronale anomala”. Questo è il primo studio a individuare il ruolo dell’AIS, una regione specializzata dei motoneuroni, nella patologia della SLA.
La SLA, nota anche come malattia dei motoneuroni, provoca la progressiva degenerazione dei neuroni nel cervello e nel midollo spinale. È una malattia devastante che colpisce 1 persona su 300 nel Regno Unito, con 1 individuo su 3 che muore entro un anno dalla diagnosi. Non esiste una cura e lo sviluppo di trattamenti è difficile poiché il meccanismo della malattia è ancora poco conosciuto e coinvolge numerose mutazioni genetiche e fattori ambientali.
In questo studio, i ricercatori si sono concentrati su due delle cause genetiche più comuni, le mutazioni nei geni TDP-43 e C9ORF72. Hanno esaminato il modo in cui queste mutazioni influenzano il segmento iniziale dell’assone, la regione in cui iniziano i segnali elettrici nei neuroni. Nella SLA, si ritiene che “la segnalazione elettrica nei motoneuroni aumenti inizialmente durante le prime fasi della condizione e poi diventi gradualmente compromessa man mano che le cellule si deteriorano e perdono la capacità di rispondere adeguatamente agli stimoli”.
Utilizzando motoneuroni generati da linee di cellule staminali derivate dai pazienti, i ricercatori hanno osservato che la lunghezza della regione AIS aumenta nella fase iniziale della SLA. Ciò è accompagnato da una ridotta plasticità, in cui l’AIS perde la sua capacità di regolare la sua risposta agli stimoli in corso, con conseguente ipereccitabilità dei motoneuroni. Ciò alla fine porta ad un aumento delle contrazioni muscolari spontanee che assomigliano alle contrazioni muscolari involontarie (fascicolazioni) osservate nei pazienti affetti da SLA.
Inoltre, i ricercatori hanno osservato che i motoneuroni della SLA in stadio avanzato mostravano un accorciamento dell’AIS che porta all’ipoeccitabilità. Questo accorciamento è stato riscontrato anche nei tessuti post mortem della SLA. I ricercatori hanno affermato che “questa differenza nella lunghezza dell’AIS nella progressione della malattia merita ulteriori studi in quanto potrebbe rappresentare un cambiamento importante nella progressione della malattia, con importanti conseguenze funzionali”.
Lo studio propone che “i cambiamenti nell’attività neuronale siano causati da cambiamenti nella morfologia dell’AIS, probabilmente dovuti ad alterazioni nell’espressione della proteina di impalcatura dell’AIS e dei canali del sodio specifici dell’AIS”.
“La nostra scoperta fornisce un nuovo meccanismo alla base di una patologia chiave nella SLA. Abbiamo dimostrato che il segmento iniziale assonale ha un importante sito di disfunzione nei motoneuroni causata da diverse mutazioni genetiche. Ciò fornisce una migliore comprensione del complesso meccanismo di questa malattia e un nuovo bersaglio terapeutico per migliorare la funzione neuronale“, afferma il Dott. Ivo Lieberam, coautore corrispondente dello studio.
Leggi anche:SLA: nuovo potenziale trattamento allevia i sintomi e prolunga la vita
“Questo studio ci ha dimostrato che l’AIS è un sito chiave nelle fasi iniziali della patologia della SLA e richiede ulteriori indagini. Ora dobbiamo espandere la nostra indagine su altre regioni del midollo spinale e del cervello e su diverse mutazioni genetiche. Sarà importante esaminare se questi cambiamenti strutturali e molecolari dell’AIS destabilizzano in qualche modo i neuroni, rendendoli vulnerabili a ulteriori insulti patologici“, afferma il coautore deello studio, il Professor Juan Burrone.
Spiegano gli autori:
“La sclerosi laterale amiotrofica (SLA) è una malattia neuromuscolare fatale caratterizzata dalla progressiva degenerazione dei motoneuroni (MN) nel cervello e nel midollo spinale. Nella maggior parte dei pazienti, compresi quelli con mutazioni TDP-43 ( TARDBP ) ed espansioni dell’esanucleotide C9orf72, la proteina TDP-43 si localizza erroneamente nel citoplasma e forma aggregati ubiquitinati e iperfosforilati, processo collegato al metabolismo e alla stabilità anormali dell’RNA, nonché ai cambiamenti nello splicing dell’RNA e nell’espressione genica. L’attività neuronale disregolata, caratterizzata da ipereccitabilità precoce e successiva progressione verso l’ipoeccitabilità, è un segno patologico chiave della SLA e uno dei numerosi importanti criteri diagnostici per la malattia. L’ipereccitabilità periferica assonale e delle unità motorie causata da conduttanze anomale del Na+ guida le fascicolazioni muscolari (contrazioni spontanee) nelle prime fasi della malattia e questo ha dimostrato di essere correlato ad un aumento della gravità della malattia e una riduzione del tempo di sopravvivenza. Inoltre, il Riluzolo, uno dei pochi farmaci approvati per prolungare la durata della vita nella SLA, agisce principalmente per smorzare l’eccitabilità neuronale inibendo i canali del sodio sensibili alla tetrodotossina (TTX), dimostrando che la modulazione dell’eccitabilità neuronale può modificare gli esiti della malattia nei pazienti. Il segmento iniziale dell’assone (AIS) è una regione specializzata dell’assone prossimale dove vengono avviati i potenziali d’azione. Questo dominio subcellulare è caratterizzato da un’alta densità di canali del sodio e del potassio voltaggio-dipendenti, in particolare Nav1.1 ( SCN1A ), Nav1.2 ( SCN2A ), Nav1.6 ( SCN8A ), Kv1.1 ( KCNA1 ) e Kv7. 2/3 ( KCNQ2/3 ), che sono ancorati alla membrana mediante un’esclusiva disposizione citoscheletrica di proteine di impalcatura tra cui l’organizzatore principale ankyrin-G ( ANK3 ). Approcci sperimentali e computazionali hanno dimostrato che la lunghezza dell’AIS è un determinante cruciale della conduttanza del sodio durante l’inizio del potenziale d’azione (AP) e consente di regolare con precisione l’eccitabilità e l’output neuronale in un sito specifico, a valle delle influenze sinaptiche e somato-dendritiche. In effetti, studi sperimentali chiave hanno dimostrato che l’AIS può subire forme uniche di plasticità dipendente dall’attività, per cui un’attività elevata porta ad un accorciamento o alla rilocalizzazione distale dell’AIS, mentre un’attività ridotta può provocare il fenotipo opposto. Questo è stato proposto come una forma di plasticità omeostatica importante per regolare l’eccitabilità intrinseca, stabilizzare l’output neuronale e prevenire livelli anormali di attività di rete. In questo studio, abbiamo cercato di determinare se i cambiamenti strutturali, funzionali e molecolari dell’AIS potessero guidare una regolazione anormale dell’eccitabilità neuronale intrinseca nei neuroni neuronali e nelle unità motorie della SLA”.
Fonte:Cell Reports