Antibiotici-immagine: James Collins, Andrés Cubillos-Ruiz e Raphaël Gayet hanno co-fondato l’azienda biotecnologica Florey Biosciences. Credit Nature.
La moglie di Andrés Cubillos-Ruiz era incinta di quattro mesi quando, in seguito a una normale procedura dentistica, le è stata somministrata una terapia antibiotica per impedire ai batteri invasivi di insediarsi nelle sue gengive.
Ma gli effetti battericidi di questi farmaci non si limitavano alla bocca. Come la maggior parte degli antibiotici sistemici, sconvolgevano anche il fragile equilibrio dei microrganismi benefici che vivono nell’intestino e, dato il legame tra la salute intestinale materna e lo sviluppo fetale, Cubillos-Ruiz temeva che l’esposizione agli antibiotici potesse compromettere la salute della loro figlia futura.
È una preoccupazione ben nota: gli antibiotici sono essenziali per combattere le infezioni batteriche pericolose, ma non distinguono tra microbi dannosi e benefici. Le comunità microbiche intestinali sono spesso sbilanciate e possono volerci mesi prima che si riprendano completamente. Fino a quando non lo fanno, le persone sono più vulnerabili alle infezioni opportunistiche e a una serie di complicazioni immunitarie, metaboliche e cognitive.
“L’impiego di un antibiotico non è un atto benigno”, afferma Gautam Dantas, ricercatore di genomica microbica presso la Washington University School of Medicine di St. Louis, Missouri. “I farmaci spesso causano “danni collaterali“, spiega, “alterando gli ecosistemi microbici in modi che possono avere effetti sulla salute a lungo termine”.
I ricercatori hanno cercato di porre rimedio al problema con composti che neutralizzano selettivamente gli antibiotici nell’intestino senza influire sul resto dell’organismo, ma questi sforzi hanno avuto scarso successo. Di fronte alla mancanza di una soluzione praticabile per sua moglie, Cubillos-Ruiz, un microbiologo, ha deciso di affrontare il problema di petto.
Lavorando nel laboratorio del biologo sintetico James Collins presso il Massachusetts Institute of Technology (MIT) di Cambridge e il vicino Wyss Institute di Boston, Massachusetts, Cubillos-Ruiz ha preso un batterio comunemente presente negli alimenti fermentati e lo ha modificato geneticamente per scomporre in modo sicuro una classe di antibiotici chiamati β-lattamici. Tra questi farmaci antibatterici c’è l’amoxicillina, il farmaco che la moglie di Cubillos-Ruiz aveva assunto dopo l’intervento di chirurgia dentale.
Cubillos-Ruiz e Collins hanno dotato il loro microbo ingegnerizzato della capacità di produrre un enzima β-lattamasi che degrada l’amoxicillina. Negli esperimenti sui topi, questo bioterapeutico vivente ha rilasciato il suo carico di neutralizzazione degli antibiotici direttamente nell’intestino, proteggendo i microbi al suo interno dagli effetti dell’antibiotico. Ma, cosa fondamentale, l’antibiotico ha mantenuto la sua capacità di combattere le infezioni in altre parti del corpo.
Riconoscendo il potenziale della loro scoperta e la diffusa necessità clinica – milioni di prescrizioni di antibiotici vengono emesse ogni giorno in tutto il mondo – Cubillos-Ruiz e Collins hanno fondato un’azienda per mettere a disposizione delle persone la loro innovazione per la difesa dell’intestino. Nell’ottobre 2024, insieme al biologo Raphaël Gayet, hanno fondato Florey Biosciences, in onore di Howard Florey, il farmacologo australiano che nel 1945 vinse il Premio Nobel per la Medicina o la Fisiologia per lo sviluppo della penicillina.
Altre aziende vendono probiotici per compensare i danni causati dagli antibiotici. Tuttavia, gli studi dimostrano che questi integratori – in genere un cocktail di batteri presenti in un intestino sano – non ripristinano efficacemente la diversità microbica e potrebbero persino ritardare il naturale processo di recupero dell’intestino. Sebbene siano stati compiuti altri sforzi per sviluppare prodotti farmaceutici che impediscano in primo luogo l’esaurimento dei microbi benefici, nessuno di essi ha ancora superato con successo le sfide normative necessarie per immettere un prodotto del genere sul mercato.
Grazie al suo microbio ingegnerizzato in grado di difendere l’intestino, la Florey Biosciences di Boston afferma di poter fare di meglio e, così facendo, spostare il modello di terapia antibiotica verso approcci che eliminano le infezioni dannose senza alterare il delicato equilibrio del microbioma intestinale sano.
Guardiani della salute intestinale
Il fallimento di diversi approcci un tempo promettenti per ridurre i danni collaterali degli antibiotici è spesso dovuto a problemi commerciali e normativi, piuttosto che a ostacoli biologici.
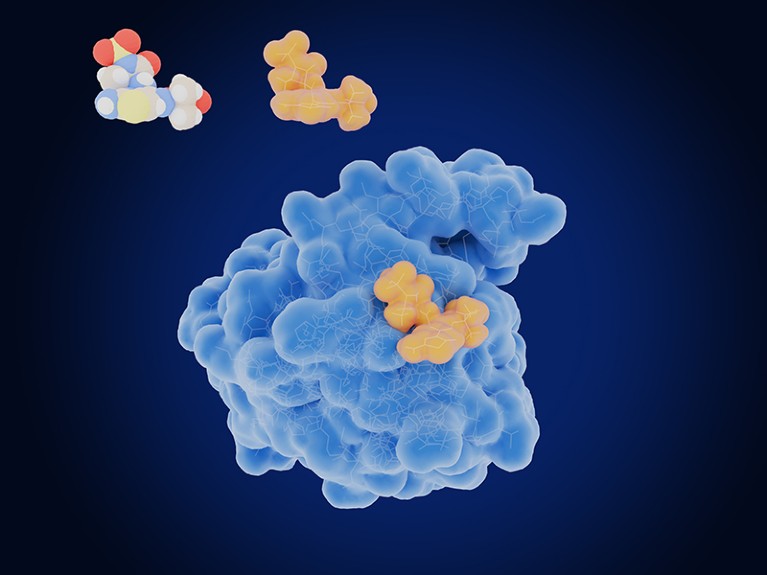
L’enzima β-lattamasi (blu) può scomporre alcuni antibiotici. Crediti: JUAN GAERTNER/SPL
Si consideri, ad esempio, DAV132: una preparazione di carbone attivo progettata per legarsi e neutralizzare gli antibiotici nel colon. Studi condotti alla fine del decennio 2010, sia su volontari sani che su pazienti ricoverati in ospedale, hanno dimostrato che l‘assunzione del farmaco insieme agli antibiotici ha contribuito a proteggere il microbioma intestinale da disturbi, senza compromettere l’efficacia degli antibiotici nel flusso sanguigno.
Maria Vehreschild, specialista in malattie infettive presso l’Ospedale Universitario di Francoforte, in Germania, ha visto quei primi risultati come una chiara prova che DAV132 stava funzionando come previsto. “Sono convinta che funzioni”, afferma.
Tuttavia, la protezione della diversità microbica non è riconosciuta come un beneficio per la salute sufficiente per ottenere l’autorizzazione normativa. Per soddisfare gli standard di approvazione, Da Volterra, l’azienda con sede a Parigi che ha sviluppato DAV132, avrebbe dovuto dimostrare che il farmaco di accompagnamento potesse prevenire infezioni potenzialmente letali nelle persone che assumevano antibiotici.
La storia suggeriva che questo sarebbe stato impegnativo. Anni prima, un’azienda chiamata Synthetic Biologics (ora nota come Theriva Biologics) di Rockville, nel Maryland, aveva sviluppato una formulazione purificata di β-lattamasi, che non richiedeva l’ingegneria genetica. Nel 2015, l’azienda ha avviato uno studio clinico controllato con placebo su centinaia di persone ricoverate in ospedale per polmonite, tutte trattate con un potente antibiotico β-lattamico ad ampio spettro.
Sebbene questi antibiotici siano efficaci contro le infezioni respiratorie, il trattamento rende le persone vulnerabili al Clostridioides difficile, un agente patogeno potenzialmente mortale che causa diarrea grave e colite. Lo studio ha indicato che coloro che hanno ricevuto la β-lattamasi protettiva per l’intestino, chiamata SYN-004, insieme all’antibiotico, hanno avuto una ridotta incidenza di infezione da C. difficile.
Tuttavia, il numero complessivo di infezioni osservate nello studio è stato basso: solo 7 persone su 206 nel gruppo placebo hanno contratto il C. difficile e 2 su 207 hanno ricevuto il trattamento attivo. Con un’incidenza così bassa di infezioni documentate, Synthetic Biologics ha stimato di aver bisogno di ulteriori 80 milioni di dollari per uno studio più ampio per confermare i benefici di SYN-004 per la salute intestinale, secondo Vince Wacher, responsabile dello sviluppo del prodotto.
Nessun investitore voleva correre il rischio. “Questa è la sfida della prevenzione”, afferma Wacher. “È qualcosa di difficile da vendere”.
Prevenzione proattiva
Con risorse finanziarie limitate, Synthetic Biologics ha concentrato la sua attenzione su un’area completamente diversa dello sviluppo di farmaci: le terapie virali che uccidono il cancro.
Tuttavia, SYN-004 non è stato abbandonato del tutto. L’azienda ha optato per un’ulteriore possibilità di sperimentazione del farmaco β-lattamasi, ma con un target più ristretto per rendere la sperimentazione clinica più fattibile: pazienti con tumore del sangue sottoposti a trapianto di cellule staminali da midollo osseo di donatore.
Gli antibiotici sono una componente cruciale del regime terapeutico per questo gruppo, ma possono scatenare complicanze immuno-correlate, in particolare la malattia del trapianto contro l’ospite, che colpisce fino alla metà di questi individui. Rispetto all’obiettivo iniziale dell’azienda, le opportunità di mercato sono significativamente inferiori. Solo circa 40.000 persone in tutto il mondo si sottopongono a questo tipo di terapia di trapianto ogni anno, rispetto ai milioni che ricevono antibiotici β-lattamici per altri motivi ogni giorno. Sono in corso i primi test di SYN-004 per questa indicazione specialistica.

Giocatori nascosti: i virus che uccidono i batteri del microbioma intestinale
Nello sviluppo di DAV132, Da Volterra ha cercato di fare la differenza, puntando a bilanciare un’ampia inclusione di pazienti con un’attenzione particolare a quelli più suscettibili alle complicazioni derivanti da disturbi intestinali indotti da antibiotici. Il suo studio cardine avrebbe coinvolto anche persone con tumori del sangue in terapia antibiotica, ma lo studio avrebbe preso in considerazione una popolazione molto più ampia: persone sottoposte a chemioterapia intensiva, circa il 10-20% delle quali sviluppa infezioni da C. difficile.
Leggi anche: Antibiotici: come contribuiscono al rischio di IBD
Nel 2021 è stato avviato uno studio clinico globale per DAV132, con l’obiettivo di arruolare 900 partecipanti. Tuttavia, l’azienda ha incontrato difficoltà con il reclutamento, la compliance e la fidelizzazione. Dopo un anno, solo 73 persone si erano iscritte e più della metà di queste ha abbandonato abbastanza rapidamente. Le complesse esigenze mediche e i brevi orizzonti di sopravvivenza della coorte la rendevano “una popolazione di studio eccezionalmente difficile”, hanno concluso Vehreschild e i suoi colleghi autori dello studio. Da Volterra ha interrotto anticipatamente lo studio e alla fine ha dichiarato bancarotta, relegando DAV132 negli annali della storia farmaceutica.
Per evitare un destino simile, Florey Biosciences intende promuovere il suo microbo ingegnerizzato come “alimento medico”, una classificazione normativa che potrebbe semplificarne l’immissione sul mercato e ridurre sostanzialmente i costi di sviluppo. Questo perché gli alimenti medici, definiti come alimenti appositamente formulati e somministrati nell’apparato digerente sotto supervisione medica attiva, devono solo rispettare gli standard di sicurezza e dimostrare l’idoneità alla gestione di specifiche condizioni di salute. Sono esenti dagli ampi studi clinici richiesti per i prodotti farmaceutici.
Caratteristiche di sicurezza
Florey Biosciences ha inoltre implementato alcuni miglioramenti nella progettazione sintetica per aumentare le possibilità di ottenere un impatto terapeutico. Il prodotto di punta dell’azienda, denominato FLR-101, è ora basato su un ceppo geneticamente modificato di Saccharomyces boulardii, una specie strettamente correlata al lievito di birra ( Saccharomyces cerevisiae ) che viene già venduto nella sua forma naturale come probiotico per trattare e prevenire i problemi digestivi.
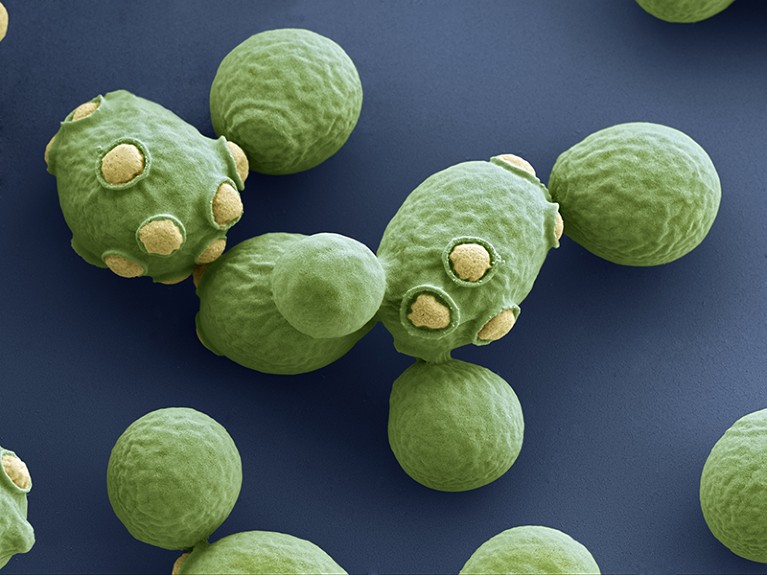
Il lievito di birra ( Saccharomyces cerevisiae ) viene venduto come probiotico per trattare i problemi digestivi. Crediti: EYE OF SCIENCE/SPL
Secondo Cubillos-Ruiz (ora amministratore delegato di Florey Biosciences), questo passaggio da un batterio a un lievito è stato effettuato per due motivi: massimizzare la quantità di enzima β-lattamasi espressa e garantire che le proprietà di degradazione dei farmaci del microbo progettato non si diffondano alla popolazione più ampia di batteri intestinali.
Johann Pitout, microbiologo medico presso la Cummings School of Medicine dell’Università di Calgary in Canada, mette in guardia dal rischio che i tratti geneticamente modificati possano essere trasferiti ad altri microbi, alimentando potenzialmente una diffusa resistenza agli antibiotici. “È un gioco molto pericoloso“, afferma.
Per mitigare questo rischio, Cubillos-Ruiz e colleghi, in uno studio sperimentale sui topi, hanno suddiviso il sistema di espressione della β-lattamasi ingegnerizzato in due componenti. Ciò significa che, anche se si verificasse un trasferimento genico tra microbi, sarebbe significativamente più difficile per i riceventi acquisire la funzionalità completa. “Devo dire che è davvero impressionante”, afferma Pitout.
Optando per il lievito anziché per un batterio, Florey Biosciences aggiunge un ulteriore livello di sicurezza. Il trasferimento di materiale genetico tra diversi domini della vita è estremamente raro, quindi queste precauzioni dovrebbero garantire che FLR-101 non comprometta l’efficacia degli antibiotici attuali, pur offrendo benefici agli utilizzatori. “Questo non vale solo per il singolo individuo”, afferma Cubillos-Ruiz. “Ne vale anche per la salute pubblica”.
Leggi anche:
Cubillos-Ruiz è fiducioso che FLR-101, se associato ad antibiotici, causerà un danno al microbioma inferiore rispetto al trattamento con soli antibiotici, un’ipotesi che intende convalidare in studi clinici. In caso di successo, l’azienda potrebbe quindi commercializzare il lievito ingegnerizzato come soluzione mirata per la gestione delle disfunzioni intestinali, distinguendolo dagli altri probiotici disponibili in farmacia. Cubillos-Ruiz spera di lanciare il prodotto sul mercato entro il 2027.
Dopo anni di progressi intermittenti, la crescente consapevolezza dell’importanza del microbioma per la salute generale sta ora guidando un’ondata di innovazione nel campo della protezione antibiotica. “Le persone si stanno rendendo conto della necessità di gestire meglio il nostro microbioma di fronte al trattamento antibiotico“, afferma Collins. Questa consapevolezza potrebbe essere proprio la spinta che il settore stava aspettando.
Fonte: Nature

