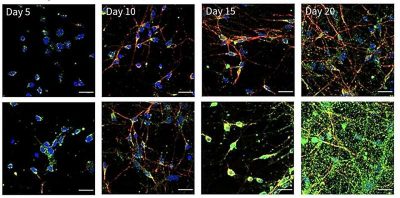
Cervello-Immagine:tenere sotto controllo la neuroinfiammazione. I neuroni normali (pannello superiore) producono una piccola quantità di DNA a doppio filamento (verde) che mantiene l’infiammazione a un livello basso e pronto a combattere i virus in arrivo. Ma se i neuroni accumulano livelli estremamente elevati di dsRNA, come osservato nei neuroni knockout per ADAR1 (pannello inferiore), possono verificarsi infiammazioni tossiche e morte neuronale. Credito: Laboratorio Chung.
Tutte le cellule viventi pullulano di acido ribonucleico (RNA), molecole che trasmettono messaggi genetici per mantenere le cellule in funzione. Ma queste molecole necessarie possono anche far scattare gli allarmi cellulari. I lunghi filamenti di RNA intrecciati nei virus, ad esempio, sono un segno rivelatore di un invasore e il sistema immunitario umano innesca l’infiammazione in loro presenza.
All’inizio della sua carriera di ricercatrice, Hachung Chung, Ph.D., si chiedeva come il sistema immunitario potesse distinguere tra l’RNA virale che causa la malattia e il nostro RNA normale. Ora, quella domanda ha portato la sua ricerca in una direzione sorprendente: lo studio delle malattie del cervello tra cui l’Alzheimer, la sclerosi laterale amiotrofica (SLA) e il lupus brain fog. Gli ultimi risultati di Chung suggeriscono che la percezione errata del nostro RNA nel cervello potrebbe essere la causa dell’infiammazione cronica in condizioni come queste.
“Penso che le malattie neurodegenerative siano l’ultima frontiera della biomedicina in cui lo sviluppo delle terapie è stato lento e confuso”, afferma Chung, assistente Professore di microbiologia e immunologia presso il Vagelos College of Physicians and Surgeons. “Penso che per molte di queste malattie, se riusciamo a sfruttare il sistema immunitario nel modo giusto, potremmo vedere una svolta“.
La convergenza tra immunologia e scienze del cervello
Gli scienziati sanno da tempo che le molecole immunitarie responsabili del riconoscimento dei virus, note come recettori di riconoscimento dei pattern, possono rilevare strutture di RNA virale a doppio filamento, che si formano quando due filamenti di RNA complementari si legano insieme.
Come ricercatore post-dottorato, Chung ha inizialmente studiato se l’enzima ADAR1 che modifica l’RNA potesse colpire i dsRNA virali e alterare il decorso dell’infezione virale. Nello stesso periodo, però, un altro ricercatore ha scoperto che le mutazioni che interrompono la funzione di ADAR1 causano la malattia autoimmune sindrome di Aicardi-Goutières (AGS), in cui il sistema immunitario attacca le cellule cerebrali sane.
Queste scoperte sorprendenti hanno suggerito che ADAR1 non era importante solo nell’infezione virale, ma era fondamentale per mantenere la pace biologica nel corpo in altri modi.
“Ho pensato che fosse davvero interessante il fatto che la mancanza di questa proteina che modifica l’RNA causasse improvvisamente sintomi così gravi nel cervello, anche quando non c’erano virus in giro”, ricorda Chung. “Mi ha reso davvero curioso cosa sta facendo la proteina per mantenerci in salute separatamente dal suo ruolo nell’infezione virale“.
Chung, che allora lavorava con il mentore Charles Rice alla Rockefeller University, scoprì che le modifiche mediate da ADAR1 apportate alle nostre molecole di RNA a doppio filamento impediscono ai recettori di riconoscimento dei pattern di innescare costantemente l’infiammazione nei tessuti sani.
Il team ha riportato i risultati su Cell nel 2018.
Questa scoperta ha soddisfatto parte della curiosità di Chung su come i recettori di riconoscimento dei pattern evitano di segnalare l’RNA umano sano, ma le domande abbondavano ancora.
“Non sappiamo ancora esattamente come funziona ADAR1 per nascondere l’RNA umano dai recettori di riconoscimento dei modelli“, afferma Chung. “Pensiamo che potrebbe creare una piccola piega nel duplex dell’RNA, rendendo più difficile l’individuazione dei recettori per il riconoscimento dei pattern“.
La ricerca di Chung sull’ADAR1 è continuata quando ha lanciato il suo laboratorio di ricerca alla Columbia University nel 2019. Voleva scoprire perché i sintomi dell’AGS erano principalmente nel cervello, quando l’RNA si trova in tutto il corpo. Se le mutazioni in ADAR1 fanno sì che il sistema immunitario riconosca l’RNA nel cervello e scateni l’infiammazione, perché non ha causato livelli altrettanto elevati di infiammazione nel cuore, nel fegato, nel sangue e altrove?
Innescare l’infiammazione del cervello
Nel suo ultimo studio, pubblicato su Science Immunology nell’ottobre 2023, due membri del laboratorio Chung, Tyler Dorrity, Ph.D., e Heegwon Shin, Ph.D., hanno ingegnerizzato le cellule staminali in modo che mancassero di ADAR1 e poi hanno convinto entrambe le cellule staminali normali e quelli senza ADAR1 a svilupparsi in neuroni e altri tipi di cellule. Hanno scoperto che i neuroni, rispetto ad altre cellule, hanno strutture di RNA a doppio filamento molto più lunghe e simili a quelle presenti nei virus.
Senza ADAR1, la maggior parte delle cellule aveva solo piccole quantità di RNA a doppio filamento affinché i recettori di riconoscimento dei pattern potessero segnalarli come pericolosi. I neuroni, invece, ne avevano moltissima. Senza ADAR1 per mascherare l’RNA, i recettori di riconoscimento dei pattern hanno immediatamente innescato l’infiammazione nei neuroni. A sua volta, l’infiammazione può aumentare i livelli dei recettori di riconoscimento dei pattern, esacerbando la risposta in un ciclo difficile da fermare.
“Una volta ottenuto questo picco iniziale di infiammazione, che sia dovuto a un virus o a una reazione autoimmune, puoi rimanere bloccato in questo ciclo in cui i recettori per il riconoscimento dei pattern continuano a trovare l’RNA e quindi si creano più recettori per il riconoscimento dei pattern”, afferma Chung.
Ciò probabilmente spiega ciò che accade nel cervello delle persone con AGS, ma suggerisce anche un possibile meccanismo per l’infiammazione difficile da fermare osservata in condizioni come la nebbia cerebrale del lupus, la SLA e il morbo di Alzheimer.
Una pattuglia continua
Per provare a combattere l’infiammazione nei neuroni isolati, il team di Chung ha ridotto i livelli di RNA a doppio filamento fluttuante nelle cellule. Sebbene ciò abbia ridotto l’infiammazione, ha portato anche a un’altra sorpresa:“Ci siamo resi conto che in realtà è importante che i tuoi neuroni abbiano questo basso livello di infiammazione“, afferma Chung. “Questa piccola infiammazione innescata dall’RNA nel cervello assume il ruolo di una fiamma pilota su un fornello: mantiene il sistema immunitario attivato e pronto a reagire più rapidamente quando c’è un virus invasore”, ipotizza.
Leggi anche:Infiammazione: un sistema di smaltimento del DNA difettoso, responsabile
“Nei libri di testo, abbiamo imparato che i recettori per il riconoscimento di schemi restano seduti in attesa di agenti patogeni“, afferma Chung. “Ma la nostra ricerca sta iniziando a suggerire che forse queste molecole percepiscono sempre parte del nostro RNA e mantengono l’infiammazione accesa a un livello molto basso“.
Piuttosto che lasciarsi scoraggiare da tutte le sorprese del suo ultimo studio, Chung è più motivato che mai a comprendere la complessa interazione tra RNA e risposte immunitarie nel cervello e altrove.
“La scienza crea dipendenza”, dice. “Adoro quei momenti umilianti in cui il tuo esperimento ha funzionato, ma ti ha dato risultati totalmente diversi da quelli che ti aspettavi. Dimostra solo che c’è molto di più da capire”.
Fonte:Science Immunology