Parkinson-Immagine Astratto grafico- Credit: Journal of the American Chemical Society.
I ricercatori dell’UAB hanno identificato una regione nei primi aggregati della proteina alfa-sinucleina che può essere presa di mira per impedire la sua conversione nelle fibrille amiloidi tossiche che si accumulano nel cervello delle persone affette da morbo di Parkinson.
La scoperta è stata recentemente pubblicata sul Journal of American Chemical Society, in uno studio che fa avanzare la comprensione delle proprietà strutturali di questi aggregati iniziali o oligomeri e apre la porta allo sviluppo di nuove strategie terapeutiche per la loro inattivazione.
Lo studio è stato condotto dai ricercatori Salvador Ventura, Jaime Santos, Jordi Pujols e Irantzu Pallarès dell’Istituto di Biotecnologia e Biomedicina (IBB) e del Dipartimento di Biochimica e Biologia Molecolare.
L‘aggregazione dell’alfa-sinucleina è un segno distintivo della malattia di Parkinson e di altre sinucleinopatie. Si tratta di un processo dinamico in cui la proteina si autoassembla per formare oligomeri che alla fine sviluppano fibrille amiloidi tossiche, che si accumulano nel cervello del paziente.
Gli oligomeri dell’alfa-sinucleina svolgono un ruolo chiave nello sviluppo e nella progressione della malattia e, pertanto, sono promettenti bersagli terapeutici e diagnostici, in particolare nelle fasi iniziali della malattia, ma la loro natura transitoria e altamente dinamica limita lo studio della loro struttura e ostacola lo sviluppo di terapie volte a bloccarli.
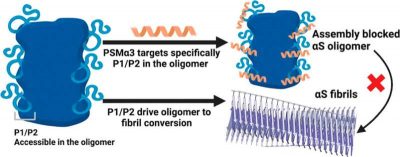
I ricercatori avevano osservato in uno studio precedente che una piccola molecola, il peptide batterico PSMα3, inibiva l’aggregazione dell’alfa-sinucleina legandosi agli oligomeri, bloccando la conversione in fibrille e inibendo la neurotossicità. In questo studio, hanno identificato dove, come e quando avviene questo legame negli oligomeri, scoprendo una regione chiave per il processo di conversione strutturale associato alla patogenesi della malattia di Parkinson.
“Abbiamo identificato la sequenza della struttura che è essenziale per la conversione degli oligomeri in fibrille, aprendo così un nuovo campo di esplorazione nella progettazione di molecole mirate a colpire gli oligomeri. Sfruttando questa regione, possiamo sviluppare nuove molecole che imitano le proprietà del PSMα3 con un’affinità ed un’efficacia molto più elevate“, spiega Ventura, Direttore del gruppo di ricerca sulle malattie del ripiegamento e della conformazione delle proteine dell’IBB e coordinatore dello studio.
Combinando analisi strutturali, biofisiche e biochimiche, i ricercatori hanno osservato che il PSMα3 agisce legandosi a un’estremità dell’alfa-sinucleina (N-terminale) che regola il processo di conversione da oligomero a fibrilla. Dopo il legame, il peptide copre due piccole regioni adiacenti della proteina, P1 e P2, che si sono rivelate critiche per questa transizione patogena.
“Questa regione è un bersaglio terapeutico ideale, perché viene riconosciuta dai peptidi solo quando fa parte degli oligomeri; questo ci permette di colpire gli aggregati senza incidere sulla forma monomerica funzionale dell’alfa-sinucleina, necessaria per il corretto funzionamento del cervello“, afferma Ventura.
Una regione rilevante anche per la malattia di Parkinson familiare
Lo studio è stato importante anche per approfondire i meccanismi molecolari alla base della malattia di Parkinson familiare. Questa variante, che colpisce solitamente le persone di età più giovane, è spesso associata a mutazioni localizzate nella regione P2 dell’alfa-sinucleina, come la mutazione G51D, che produce una delle forme più aggressive della malattia.
I ricercatori hanno dimostrato che la mutazione G51D nella regione critica identificata provoca fluttuazioni conformazionali che ritardano la conversione da oligomero a fibrilla. Questo ritardo sarebbe la causa di un accumulo di oligomeri tossici e di lunga vita che non vengono processati efficacemente dagli chaperon molecolari che cercano di mantenerli disaggregati.
Catturano invece da questo meccanismo di disaggregazione, gli elementi essenziali necessari per il corretto funzionamento dei neuroni. L’evasione o il deterioramento del corretto funzionamento del meccanismo di controllo delle proteine potrebbe spiegare perché questa e altre mutazioni ereditarie causano l’esordio precoce della malattia di Parkinson, in un’età in cui si presume che l’omeostasi proteica debba essere preservata.
Leggi anche:Parkinson: scoperti potenziali biomarcatori delle esposizioni ambientali nella malattia
“La nostra scoperta potrebbe portare allo sviluppo di peptidi specifici in grado di colpire queste forme mutate di alfa-sinucleina e, quindi, a un approccio terapeutico personalizzato per coloro che soffrono di malattia di Parkinson familiare. Stiamo già lavorando allo sviluppo di queste molecole“, afferma Ventura.
Fonte:Journal of the American Chemical Society