Immagine: Public Domain.
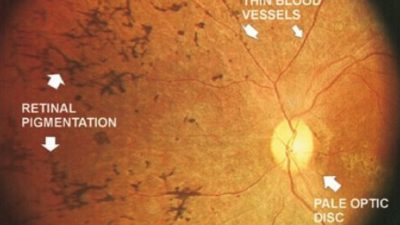
La retinite pigmentosa è la forma più diffusa di cecità congenita. Utilizzando un modello murino di retinite pigmentosa, i ricercatori della Ludwig-Maximilians Universitaet (LMU) di Monaco hanno ora dimostrato che l’attivazione mirata di geni con funzioni simili può compensare il difetto primario.
Fino a 40.000 persone in Germania soffrono di retinite pigmentosa. Questa malattia ereditaria è caratterizzata dalla perdita di fotorecettori nella retina e può essere causata da mutazioni in molti geni diversi.
A seconda della natura del difetto genetico sottostante, la gravità della condizione può variare tra la cecità notturna e la progressiva perdita del campo visivo e alla fine può portare alla cecità totale. Recentemente sono state approvate le prime terapie geniche per la malattia.
Tuttavia, questi approcci presentano alcuni svantaggi che limitano il loro campo di applicazione. Un gruppo di ricerca guidato dal PD Dr. Elvir Becirovic presso il Dipartimento di Farmacologia delle Scienze Naturali (Responsabile: Prof.Dr.Martin Biel) ha sviluppato una nuova strategia in collaborazione con il Prof. Stilianos Michalakis della Clinica di oftalmologia della LMU Medical Centro.
Vedi anche:Retinite pigmentosa: il sistema del complemento impedisce la degenerazione retinica
Questo approccio è progettato per compensare il difetto ereditario causale attivando geni con funzioni simili che sono normalmente represse nei tessuti colpiti e utilizza una variante della tecnologia CRISPR / Cas9 descritta per la prima volta nel 2015.
Nella rivista Science Advances, il team descrive la prima applicazione riuscita di questo metodo nel contesto della terapia genica.
Attualmente, nello sviluppo di terapie geniche vengono utilizzate due strategie: nel contesto dell’integrazione genica, si tenta di sostituire il gene difettoso con una versione intatta. Tuttavia, questo è attualmente possibile solo per geni relativamente piccoli.
La seconda strategia mira a correggere le mutazioni che causano la malattia, ma questo di solito deve essere adattato a ogni singola mutazione. In considerazione dell’elevato impegno e dei costi di sviluppo associati, non è quindi possibile un’applicazione ampia di questa strategia. “Per superare questi limiti, abbiamo sviluppato una nuova strategia”, afferma Becirovic.
Molti geni nel genoma umano rientrano in famiglie i cui membri svolgono funzioni simili in diversi tipi di cellule o vengono attivati in fasi diverse durante la differenziazione di un particolare tipo di cellula. “La nostra idea era di compensare la perdita di funzione del gene mutante attivando in modo specifico i geni che hanno una funzione simile, ma normalmente non sono espressi nelle cellule della retina“, afferma Becirovic.
“Per fare ciò, abbiamo introdotto un sistema chiamato Cas9-VPR nelle cellule colpite della retina”. Il sistema Cas9-VPR è un derivato della tecnologia CRISPR / Cas9 ampiamente utilizzata per la modifica mirata dei geni. Simile al classico sistema CRISPR / Cas9, Cas9-VPR utilizza lo stesso principio di target per guidare una proteina attivante al particolare gene di interesse.
Becirovic e colleghi hanno utilizzato un modello murino per la retinite pigmentosa per testare l’approccio di attivazione. Questi topi mancano della proteina rodopsina sensibile alla luce che è normalmente espressa esclusivamente nei bastoncelli della retina, che sono necessari per la visione della luce fioca e per la visione notturna.
I ricercatori hanno introdotto il sistema Cas9-VPR nei bastoncelli con l’aiuto di un virus innocuo. Introducendo Cas9-VPR nei bastoncelli dei topi, gli scienziati hanno attivato geni strettamente correlati al gene della rodopsina, che sono normalmente attivi nei coni responsabili della visione del colore e della luce diurna.
“In questo modo, siamo stati in grado di compensare la mancanza di funzione della rodopsina nelle cellule dei bastoncelli, per attenuare il tasso di degenerazione retinica e migliorare la funzione retinica senza effetti collaterali rilevabili“, afferma Becirovic.
Gli autori ritengono che una strategia simile possa essere applicata a un’ampia gamma di geni e malattie genetiche e offre una serie di vantaggi significativi rispetto alle strategie esistenti.
“Data la crescente importanza della terapia genica e dei suoi potenziali benefici per i pazienti, siamo convinti che il nostro approccio potrebbe presto essere utilizzato nei primi studi di fattibilità clinica”, dice il Dr. Elvir Becirovic, Dipartimento di Farmacologia delle Scienze Naturali, Università Ludwig-Maximilians