Immagine: Public Domain.
Gli scienziati del MIT hanno identificato una potenziale nuova strategia per il trattamento della Sindrome dell’X Fragile, un disturbo che è la principale causa ereditaria di disabilità intellettiva e autismo.
In uno studio sui topi, i ricercatori hanno dimostrato che l’inibizione di un enzima chiamato GSK3 alfa ha invertito molte delle caratteristiche comportamentali e cellulari dell’X Fragile. Il composto di piccole molecole è stato concesso in licenza per un ulteriore sviluppo e possibili sperimentazioni cliniche sull’uomo. “Dagli studi sui topi, ci sono segni che questo composto potrebbe non avere gli stessi limiti di un’altra classe di farmaci per l’X Fragile, falliti negli studi clinici sull’uomo alcuni anni fa”, afferma Mark Bear, Professore di Neuroscienze del MIT Institute for Learning and Memory e uno degli autori senior dello studio.
“Gli inibitori di GSK3 potrebbero anche essere utili contro altre malattie in cui GSK3 svolge un ruolo, tra cui il morbo di Alzheimer”, dice il ricercatore. Florence Wagner, Direttore di chimica presso Stanley Center for Psychiatric Research del Broad Institute, è anche autore senior dello studio che appare oggi in Science Translational Medicine. Gli autori principali sono il post dottorato Patrick McCamphill del MIT, la ex studentessa laureata del MIT Laura Stoppel e l’ex post dottorato del MIT Rebecca Senter.
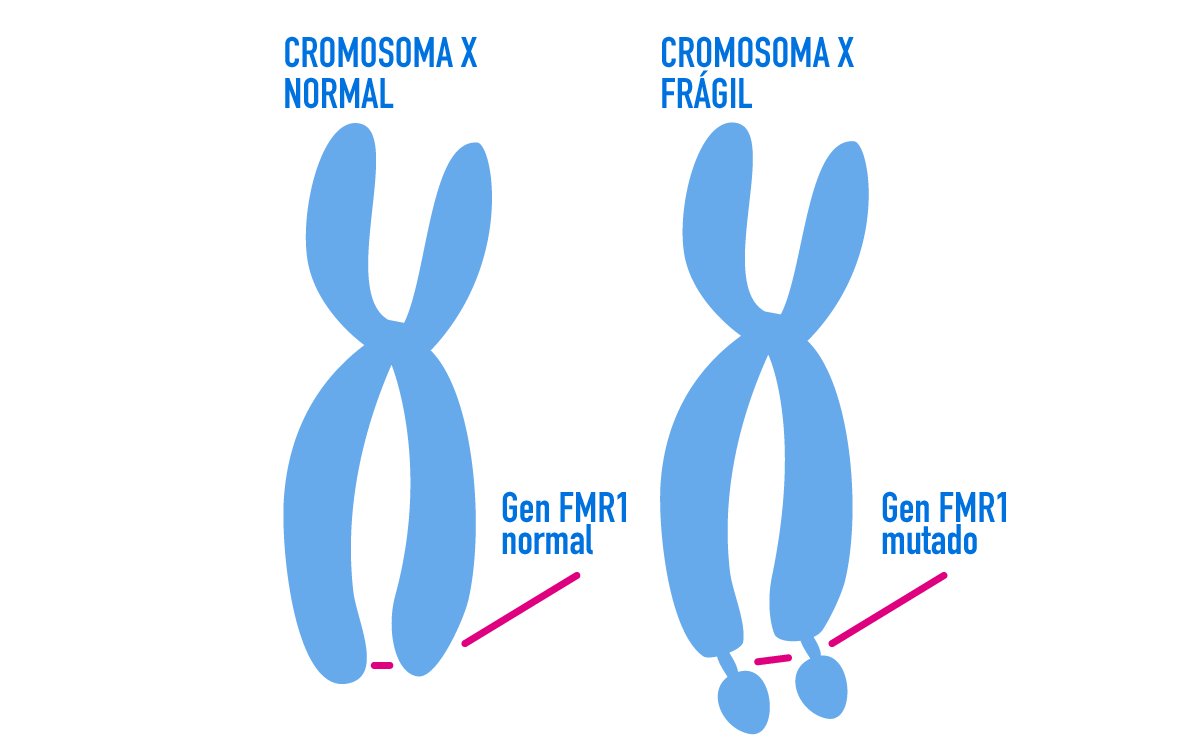
La sindrome della X Fragile colpisce circa 1 su 2.500 / 4.000 ragazzi e 1 su 7.000/ 8.000 ragazze ed è causata da una mutazione genetica di una proteina chiamata rFMRP. Il gene FMR1 (Fragile X Mental Retardation 1) posizionato sul braccio lungo del cromosoma X, presenta una rottura da cui la definizione di “X Fragile”. Oltre alla disabilità intellettiva, i sintomi includono epilessia, deficit di attenzione e iperattività, ipersensibilità al rumore e alla luce e comportamenti autistici come il battito delle mani.
Il laboratorio di Bear, che ha studiato la sindrome per circa due decenni, ha precedentemente dimostrato che la sintesi proteica nele sinapsi, le giunzioni specializzate tra i neuroni, è stimolata da un recettore neurotrasmettitore chiamato recettore metabotropico del glutammato 5 (mGluR5). FMRP regola normalmente questa sintesi proteica. Quando si perde FMRP, la sintesi proteica stimolata da mGluR5 diventa iperattiva e questo può spiegare molti dei vari sintomi osservati in Fragile X.
Negli studi sui topi, Bear e altri hanno scoperto che i composti che inibiscono il recettore mGluR5 potrebbero invertire la maggior parte dei sintomi della X fragile. Tuttavia, nessuno degli inibitori di mGluR5 che sono stati testati negli studi clinici ha avuto successo.
Nel frattempo, il team del MIT, insieme a molti altri gruppi di ricerca, ha cercato altre molecole che potrebbero essere prese di mira per il trattamento dell’X Fragile. “Noi e molti altri laboratori ci siamo occupati di questo e abbiamo cercato di capire i principali attori molecolari. Ora ci sono state diverse manipolazioni nel percorso di segnalazione che possono correggere i fenotipi X fragili negli animali”, afferma Bear.
Alcuni studi hanno suggerito che GSK3 era iperattivo nei modelli di topo X Fragile X e che questa attività poteva essere limitata usando il litio. Tuttavia, il dosaggio richiesto di litio ha effetti collaterali negativi nei bambini. Le società farmaceutiche hanno sviluppato altri farmaci a piccole molecole che inibiscono GSK3, ma questi hanno innescato un accumulo di una proteina chiamata beta-catenina, che può portare alla proliferazione cellulare cancerosa. L’enzima GSK3 si presenta in due forme, alfa e beta, quindi Wagner, insieme a Edward Holson, ex Direttore della Facoltà di chimica presso lo Stanley Center e Edward Scolnick, capo scienziato emerito presso lo Stanley Center, hanno iniziato a sviluppare farmaci che inibirebbero l’una o l’altra forma.
“Sono stati pubblicati studi che dimostrano che se si eliminano selettivamente la forma alfa o la beta, non si innesca l’accumulo della beta-catenina”, afferma Wagner. “Gli inibitori GSK3 erano già stati testati sui modelli X Fragile, ma non sono utilizzabili a causa del problema della tossicità”. Dopo uno screening di oltre 400.000 composti farmacologici, Wagner ha ne identificato una manciata che ha inibito entrambe le forme di GSK3. Modificando leggermente le loro strutture, ha poi inventato versioni che potevano scegliere come target le forme alfa o beta.
Il laboratorio di Bear ha testato gli inibitori selettivi nei topi geneticamente modificati che mancano della proteina FMRP e ha scoperto che l’inibitore specifico del GSK3 alfa ha eliminato uno dei comuni sintomi dell’X fragile: convulsioni indotte da forti rumori. Successivamente, hanno scoperto che l’inibitore GSK3 alfa ha anche invertito con successo diversi altri sintomi di Fragile X, mentre l’inibitore beta GSK3 no.
Questi sintomi includono sovrapproduzione di proteine, alterata plasticità sinaptica, compromissione di alcuni tipi di apprendimento e memoria e ipereccitabilità di alcuni neuroni.
Esplorare gli effetti collaterali
GSK3 è una chinasi, il che significa che controlla altre proteine aggiungendo loro gruppi chimici chiamati fosfati, ma il suo esatto ruolo in Fragile X non è ancora noto. In questo studio, i ricercatori hanno scoperto che GSK3 fa parte dello stesso percorso di segnalazione controllato da mGluR5, ma GSK3 sembra agire più avanti nel percorso. “I risultati iniziali nei topi suggeriscono che gli inibitori alfa GSK3 non presentano alcune delle complicazioni che potrebbero aver causato il fallimento degli inibitori mGluR5 negli studi clinici“, afferma Bear. In questi studi, è stato scoperto che gli inibitori di mGluR5 causano allucinazioni in alcune persone, il che limita la dose che può essere somministrata. (Nei topi, le allucinazioni non possono essere misurate direttamente, ma esistono tecniche per testare indirettamente il potenziale allucinogeno.) Gli studi sui topi hanno dimostrato che gli inibitori di mGluR5 hanno il potenziale per causare allucinazioni, ma non gli inibitori dell’alfa GSK3.
Un altro effetto collaterale osservato negli studi sui topi sugli inibitori di mGluR5 è lo sviluppo della resistenza al trattamento a lungo termine, per alcuni dei sintomi del disturbo. “Non sappiamo se gli studi mGluR siano falliti a causa della resistenza al trattamento, ma si tratta di un’ipotesi praticabile”, afferma Bear. Gli inibitori di GSK3 possono anche essere promettenti per il trattamento di altre malattie in cui GSK3 svolge un ruolo. In uno studio di Science Translational Medicine pubblicato lo scorso anno, il co-autore di Wagner, i ricercatori del Broad Institute e del Dana-Farber Cancer Institute hanno dimostrato che gli inibitori selettivi di GSK3 potrebbero essere efficaci contro la leucemia mieloide acuta. GSK3 potrebbe anche essere un potenziale bersaglio per il trattamento dell’Alzheimer, poiché è responsabile del Tau fosforilante, una proteina che forma grovigli nel cervello dei malati di Alzheimer.potenziale bersaglio per il trattamento dell’Alzheimer.
Fonte: NewsMIT