Neoplasie mieloidi-Immagine Credit Public Domain-
I ricercatori del Children’s Hospital of Philadelphia (CHOP) hanno identificato una molecola che svolge un ruolo nella modifica e attivazione post-traduzionale nelle neoplasie mieloidi, rendendola un potenziale bersaglio terapeutico.
I risultati dello studio sono stati pubblicati sul Journal of Clinical Investigation.
Un gruppo di proteine note come proteine RAS controlla le vie di segnalazione che regolano diversi aspetti importanti della normale crescita cellulare e, quando disregolata, della trasformazione maligna. Le mutazioni nelle proteine lungo il percorso RAS sono tra i driver oncogenici più diffusi nei tumori, quindi c’è stato interesse tra i ricercatori nel prendere di mira questo percorso per interrompere la crescita delle cellule tumorali. Le mutazioni nei geni KRAS e NRAS sono spesso identificate nelle malattie mieloidi (15%-60%), tra cui la leucemia mieloide acuta (LMA) e la leucemia mielomonocitica cronica (CMML).
Le proteine RAS trasmettono segnali solo quando sono associate alle membrane cellulari; ciò accade quando le molecole di grasso, note come lipidi, vengono aggiunte alla proteina RAS, consentendone il traffico attraverso le membrane cellulari. Il ciclo di traffico attraverso le membrane è molto veloce e si verifica ogni 10-20 minuti. Il team CHOP ha deciso di esplorare il potenziale dell’inibizione di questo traffico di membrane identificando obiettivi che facilitano questo processo.
In tal modo, i ricercatori hanno scoperto che un enzima chiamato RAB27B facilita l’aggiunta di lipidi a NRAS e il traffico di NRAS alla membrana plasmatica, necessaria per l’attivazione. Attraverso studi proteomici, i ricercatori hanno scoperto che RAB27B è sovraregolato nelle neoplasie mieloidi mutate CBL o JAK2 e che la sua espressione è correlata a una prognosi sfavorevole nella LMA.
Inoltre, i ricercatori hanno scoperto che la deplezione di RAB27B ha inibito la crescita di linee cellulari carenti di CBL o mutanti NRAS. Hanno anche scoperto che la carenza di Rab27b nei modelli murini ha ridotto significativamente lo sviluppo della leucemia mielomonocitica cronica –CMML- in vivo. È importante sottolineare che hanno osservato che la deplezione di RAB27B nelle LMA umane primarie ha inibito la segnalazione NRAS oncogenica e la crescita leucemica. I ricercatori hanno inoltre rivelato una correlazione significativa tra l’espressione di RAB27B e la sensibilità nella LMA agli inibitori MEK, che prendono di mira le mutazioni sulla via RAS.
Spiegano gli autori:
“Le mutazioni RAS sono tra i driver oncogenici più diffusi nei tumori. Le proteine RAS propagano i segnali solo quando sono associate alle membrane cellulari come conseguenza delle modifiche lipidiche che ne influenzano il traffico. In questo studio abbiamo scoperto che RAB27B, una piccola GTPase della famiglia RAB, controllava la palmitoilazione NRAS e il traffico verso la membrana plasmatica, una localizzazione richiesta per l’attivazione. I nostri studi proteomici hanno rivelato la sovraregolazione di RAB27B nelle neoplasie mieloidi mutate con CBL o JAK2 e la sua espressione era correlata con una prognosi sfavorevole nelle leucemie mieloidi acute (LMA). La deplezione di RAB27B ha inibito la crescita di linee cellulari mutanti carenti di CBL o NRAS. Sorprendentemente, la carenza Rab27b nei topi ha abrogato il mutante, ma non la crescita delle cellule progenitrici mediate da WT NRAS, la segnalazione ERK e la palmitoilazione NRAS. Inoltre, la carenza di Rab27b ha ridotto significativamente lo sviluppo della leucemia mielomonocitica in vivo. Meccanicisticamente, RAB27B ha interagito con ZDHHC9, una palmitoil aciltransferasi che modifica NRAS. È importante sottolineare che l’esaurimento di RAB27B nelle LMA umane primarie ha inibito la segnalazione NRAS oncogenica e la crescita leucemica. Abbiamo inoltre rivelato una correlazione significativa tra espressione RAB27B e sensibilità agli inibitori di MEK nelle LMA. Pertanto, i nostri studi hanno presentato un collegamento tra le proteine RAB e gli aspetti fondamentali della modifica e del traffico post-traduzionali della RAS, evidenziando le future strategie terapeutiche per i tumori guidati dalla RAS“.
Astratto grafico:
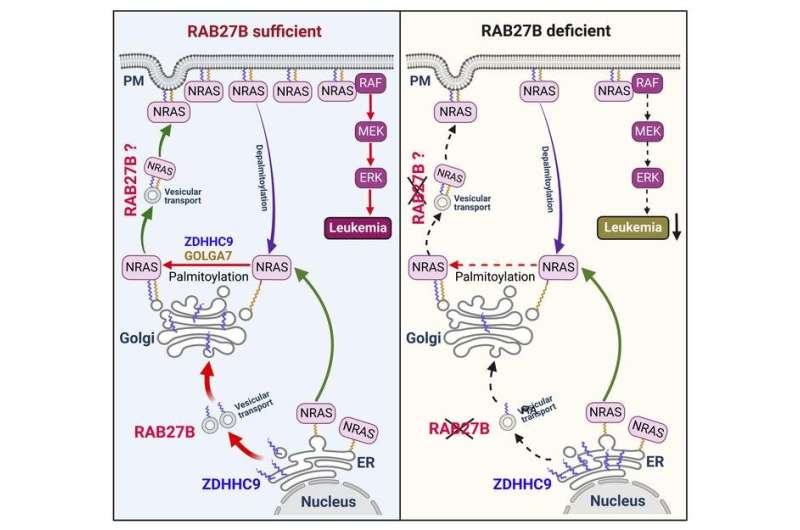
Immagine astratto grafico. Credito: Journal of Clinical Investigation (2023).
Leggi anche:Neoplasie mieloidi: sistema NGS integrato può fornire diagnosi accurate
“Il nostro studio presenta un collegamento tra le proteine RAB e gli aspetti fondamentali della modifica post-traduzionale e del traffico di RAS, evidenziando le future strategie terapeutiche per i tumori guidati da RAS“, ha affermato l’autore senior dello studio Wei Tong, Ph.D., ricercatore e Professore di ematologia pediatrica presso il CHOP. “Questi risultati indicano che RAB27B è un bersaglio terapeutico sicuro e promettente per i tumori maligni mutanti CBL o NRAS“.