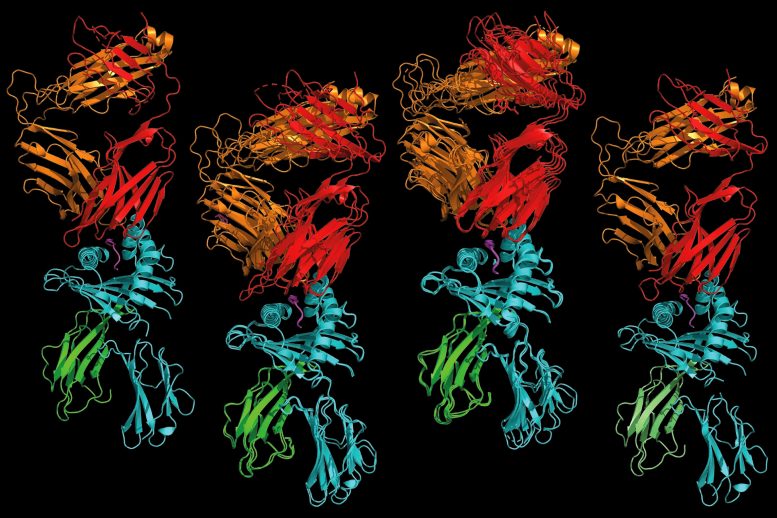
Il recettore della cellula AT che riconosce un frammento proteico umano (a sinistra) è notevolmente simile a quello che riconosce un frammento proteico batterico (a destra) e a due recettori in grado di riconoscere frammenti proteici sia umani che batterici (al centro). Uno studio condotto da ricercatori della Washington University School of Medicine di St. Louis e colleghi della Stanford University e dell’Università di Oxford supporta l’idea che alcune cellule T che reagiscono ai microbi possono anche reagire alle normali proteine umane, causando malattie autoimmuni. I risultati promettono di accelerare gli sforzi per migliorare gli strumenti diagnostici e i trattamenti per le malattie autoimmuni. Crediti: Xinbo Yang e K. Chris Garcia
Lo studio apre la strada a una migliore diagnosi e trattamento delle malattie autoimmuni.
I ricercatori della Washington University, della Stanford University e della Oxford University hanno sviluppato un metodo per identificare frammenti proteici e cellule immunitarie che causano reazioni autoimmuni. Lo studio si concentra sulla variante HLA-B*27 legata alla spondilite anchilosante e all’uveite anteriore acuta. La svolta potrebbe portare a una migliore diagnosi e trattamento delle malattie autoimmuni.
Si pensa che le malattie autoimmuni siano il risultato di un’identità errata. Cellule immunitarie di pattuglia, armate e pronte a difendere il corpo dagli agenti patogeni invasori, scambiano le normali cellule umane per cellule infette e puntano le armi sui propri tessuti sani. Nella maggior parte dei casi, tuttavia, trovare la fonte della confusione – il minuscolo frammento di normale proteina umana che sembra pericolosamente simile a una proteina di un agente patogeno – è stata una sfida per gli scienziati. Quel pezzo mancante del puzzle ha ostacolato gli sforzi per sviluppare una diagnostica efficace e terapie specifiche per molte condizioni autoimmuni.
“Di tutti i geni, i geni HLA hanno la maggior quantità di variazione nella popolazione umana. Esistono molte, molte malattie autoimmuni associate a varianti specifiche dei geni HLA e, nella maggior parte dei casi, non sappiamo perché “, ha affermato il co-autore senior dello studio Wayne M. Yokoyama, MD, Sam J. Levin e Audrey Loew Levin Professore di ricerca sull’artrite alla Washington University. “Questo documento delinea una strategia per capire perché alcune varianti HLA sono collegate a determinate malattie. Fornisce anche una forte evidenza che la reattività crociata tra proteine umane e microbiche guida l’autoimmunità in almeno due malattie e probabilmente molte altre. Ora che comprendiamo i driver sottostanti, possiamo iniziare a concentrarci sugli approcci che hanno maggiori probabilità di produrre benefici per i pazienti”.
Le malattie autoimmuni spondilite anchilosante, che coinvolge l’artrite della colonna vertebrale e del bacino e l’uveite anteriore acuta, caratterizzata da infiammazione dell’occhio, sono entrambe fortemente associate a una variante HLA chiamata HLA-B*27. Il legame tra spondilite anchilosante e HLA-B*27 è stato scoperto 50 anni fa, rendendola una delle prime associazioni di questo tipo identificate tra malattia e varianti HLA e rimane una delle più forti associazioni conosciute tra qualsiasi malattia e una variante HLA.
La famiglia di proteine HLA è coinvolta nell’aiutare le cellule immunitarie a rilevare i patogeni invasori e a distinguere tra proteine microbiche e umane ed è molto variabile tra gli individui. Le proteine HLA funzionano come mani che raccolgono frammenti di qualsiasi proteina stia mentendo – microbica o umana – e li mostrano alle cellule immunitarie chiamate cellule T per capire se sono un segno di pericolo (microbiche) o meno (umane).
Le cellule T non riconoscono da sole i frammenti proteici; riconoscono il frammento più la mano che lo tiene. Gli scienziati hanno a lungo ipotizzato che la combinazione di questa particolare mano – HLA-B*27 – più un po’ di una proteina umana sconosciuta fosse erroneamente identificata come pericolosa nelle persone con una delle due malattie, innescando attacchi autoimmuni negli occhi o nella colonna vertebrale. Ma per decenni non sono riusciti a trovare il frammento. Alcuni scienziati iniziarono a ipotizzare che dell’identificazione errata fosse sbagliata e che qualche altra ragione spiegasse l’associazione tra HLA-B*27 e le due malattie.
L’autore co-corrispondente K. Christopher Garcia, PhD e il co-primo autore Xinbo Yang, PhD, della Stanford Medicine, insieme agli autori co-corrispondenti Geraldine M. Gillespie, PhD, e Andrew J. McMichael, PhD e co-primo l’autore Lee Garner, PhD, dell’Università di Oxford, hanno collaborato con Yokoyama e il co-primo autore Michael Paley, MD, PhD, della Washington University su un nuovo modo per trovare il frammento sfuggente. Il team di ricerca ha identificato alcune cellule T che erano abbondanti nel sangue e nelle articolazioni delle persone con spondilite anchilosante e negli occhi delle persone con uveite
Garcia e Yang hanno quindi ideato un modo per identificare i frammenti proteici che guidano una risposta delle cellule T quando combinati con HLA-B*27 e hanno mappato i frammenti contro il genoma umano e cinque genomi batterici per identificare le proteine da cui i frammenti potrebbero aver avuto origine. Utilizzando questo approccio, sono stati in grado di restringere le milioni di possibilità a un elenco molto breve di proteine umane e microbiche. Quindi, hanno determinato le strutture delle molecole del rivelatore – note come recettori delle cellule T – sulle cellule T di entrambi i gruppi di pazienti e le hanno confrontate. Le somiglianze erano sorprendenti.
Vedi anche:Malattie autoimmuni: nuova speranza di trattamento
“Questo studio rivela il potere di studiare la specificità e l’attività delle cellule T da zero; cioè, identificare le cellule T che sono più attive in una data risposta, seguita dall’identificazione a cosa rispondono”, ha detto Garcia. “Chiaramente questi TCR derivati dal paziente stanno vedendo uno spettro di antigeni comuni e questo potrebbe guidare l’autoimmunità. Dimostrarlo negli esseri umani è molto difficile, ma questa è la nostra direzione futura e potrebbe portare a nuove terapie”.
I risultati rivelano aspetti chiave dei meccanismi biologici alla base della spondilite anchilosante, dell’uveite anteriore e potenzialmente di molte altre malattie autoimmuni.
“Combinando le tecnologie sviluppate di recente, abbiamo rivisitato una vecchia ipotesi che si chiede se la tradizionale funzione di presentazione dell’antigene dell’HLA-B*27 contribuisca all’inizio della malattia o alla patogenesi nelle condizioni autoimmuni della spondilite anchilosante e dell’uveite“, ha affermato Gillespie. “Le nostre scoperte secondo cui le cellule T nei siti della patologia riconoscono l’HLA-B*27 legato sia agli antigeni propri che a quelli microbici aggiunge uno strato molto importante di comprensione a queste condizioni complesse che presentano anche forti firme infiammatorie. La nostra speranza è che questo lavoro un giorno possa aprire la strada a terapie più mirate, non solo per queste condizioni ma, in ultima analisi, per altre malattie autoimmuni”.
Fornendo un forte supporto all’idea che le cellule T che reagiscono ai microbi possono anche reagire alle normali proteine umane, i risultati promettono di accelerare gli sforzi per migliorare gli strumenti diagnostici e i trattamenti per le malattie autoimmuni.
“Per la spondilite anchilosante, il tempo medio tra i sintomi iniziali e la diagnosi effettiva è di sette-otto anni”, ha affermato Paley, assistente Professore di medicina, oftalmologia e patologia e immunologia. “Abbreviare questo tempo con una diagnostica migliore potrebbe avere un impatto sulla vita dei pazienti, perché il trattamento potrebbe essere iniziato prima. Per quanto riguarda la terapia, se potessimo indirizzare queste cellule T che causano la malattia all’eliminazione, potremmo potenzialmente curare un paziente o forse anche prevenire la malattia nelle persone con la variante genetica ad alto rischio. C’è molto potenziale per il beneficio clinico qui.
Fonte:Nature

